
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Правила и принципы заполнения атомных орбиталей электронами
Строение многоэлектронных атомов.
Квантово-механическая модель атома использует вероятностный подход для характеристики нахождения электрона в определенной области пространства. Волновая функция Ψ («пси») – математическая функция – описывает вероятность нахождения электрона в определенной области пространства. Она характеризует амплитуду волны, как функцию координата электрона и в наиболее простом случае зависит от трех пространственных координат х, y, z и называется орбиталью.
Атомная орбиталь (АО) – область околоядерного пространства, в котором наиболее вероятно нахождение электрона. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой определенное распределение заряда, которое получило название электронного облака. АО графически изображается квадратом:
и однозначно характеризуется тремя квантовыми числами (КЧ) n, l, ml, а состояние электрона в атоме – четырьмя квантовыми числами: n, l, ml и ms.
Главное квантовое число n характеризует удаленность электрона от ядра и определяет энергию и размеры АО; принимает значения n = 1,2,3…∞ и характеризует энергетический уровень. Чем выше значение n, тем выше энергия.
Орбитальное квантовое число l - характеризует форму атомной орбитали и определяет орбитальный момент количества движения электрона; принимает целочисленные значении от 0 до (n-1) и характеризует энергетический подуровень. Энергетический уровень расщеплен на подуровни, отличающиеся энергией.
Максимальное число энергетических подуровней на n –уровне равно n (количество подуровней равно номеру уровня).
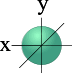
| 
|
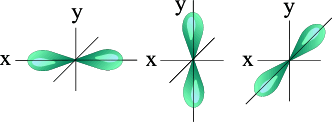
| S - орбиталь | Три p – орбитали |

|
| Пять d – орбиталей |
На подуровне:
одна s- орбиталь (сфера) □ l = 0 m l = 0
три p-орбитали (гантели) □□□ l = 1 m l = -1,0,+1
пять d-орбиталей (4-хлепестковые розы) □□□□□ l = 2 m l = -2,-1,0,+1,+2
семь f-орбиталей (сложная форма) □□□□□□□ l = 3 m l = -3,-2,-1,0,+1,+2,+3
Магнитное квантовое число ml характеризует пространственную ориентацию АО и определяет значение проекции орбитального момента количества движения электрона на произвольно выделенную ось; принимает целочисленные значения ml = - l, …, 0, …, + l.
На подуровне (2 l +1) значений ml и (2 l +1) АО.
m l - вектор (имеет величину и направление).
Все АО одного подуровня в отсутствие внешнего поля имеют одинаковую энергию (вырожденные АО).
Общее число орбиталей на n -ом энергетическом уровне равно n 2.
Спиновое квантовое число m s характеризует величину и ориентацию «спина», определяет собственный угловой момент количества движение электрона, связанный с вращением вокруг своей оси; m s принимает только два значения: +½ (↑) и -½ (↓). Электроны с разными спинами условно обозначаются противоположно направленными стрелками:
| ↑↓ |
Максимально возможное число электронов на n -ом энергетическом уровне равно 2 n 2.
На первом уровне (n=1) → один подуровень (1s) 1АО 2 ē
На втором уровне (n=2) → два подуровня (2s, 2p) 4АО 8 ē
На третьем уровне (n=3) → три подуровня (3s, 3p, 3d) 9АО 18 ē
На четвертом уровне (n=4) → четыре подуровня (4s, 4p, 4d, 4f) 16АО 32 ē
Еs<Еp<Еd<Еf для одного уровня
АО: это совокупность положений электрона в атоме с определенными n, l, m l (т.е. энергией, размерами, формой и ориентацией в пространстве), условно АО обозначают □
Не нашли, что искали? Воспользуйтесь поиском: