
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОСОБЕННОСТИ КОВАЛЕНТНОЙ СВЯЗИ
Помимо характеристик, общих для любой химической связи (энергия, длина связи), ковалентная связь имеет дополнительные особенности: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость.
Кратность
Между соединяемыми атомами могут образовываться одна, две или три связи.
Кратность (или порядок) ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами.
Пару электронов между атомами изображают соединительной чертой - валентным штрихом.
При наличии одной общей электронной пары между соединяемыми атомами говорят о простой (ординарной, или одинарной) ковалентной связи.
Например, в молекулах Н2, F2, Н2О, HF, NH3, СН4, C2H6 или сложных ионах ОН-, [NH4]+, [Zn(OH)4]2-, [Cu(NH3)4]2+ все связи между атомами ординарные и являются σ-связями.
При наличии у соединяемых атомов двух или трёх общих электронных пар между ними возникает соответственно двойная или тройная ковалентная связь. При этом одна связь – обязательно σ-связь, остальные — π-связи.
Например:


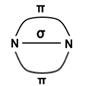
Примерами могут служить молекулы или ионы, где между атомами есть кратные (двойные или тройные) связи: N≡N (азот), Н2С=СН2 (этилен), H2C=O (формальдегид), НС≡СН (ацетилен).
С увеличением кратности ковалентной связи уменьшается её длина и повышается суммарная прочность:
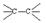

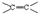
| rсв, пм[5] | |||||
| Δ r, пм | |||||
| Есв, кДж/моль | |||||
| Δ Есв, кДж/моль |
Однако увеличение энергии связи, как видно из приведённых значений, не пропорционально увеличению кратности ковалентной связи, что указывает на различия в энергиях σ- и π-связи, причём Е σ > Е π. Это объясняется тем, что эффективность перекрывания взаимодействующих атомных орбиталей в случае возникновения σ-молекулярной орбитали выше, чем при образовании π-молекулярной орбитали.
Насыщаемость
Каждый атом способен образовывать в химическом соединении определённое число ковалентных связей, благодаря этому молекулы имеют определённый состав: Н2, H2O, PCl5, СН4.
Число возможных ковалентных связей, образуемых данным атомом, зависит при обменном механизме от числа неспаренных электронов на внешних энергетических уровнях у атомов в основном и в возбуждённом состояниях, а при донорно-акцепторном — ещё и от числа свободных атомных орбиталей на внешних уровнях.
При определении числа ковалентных связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбуждённое состояние число его неспаренных электронов может увеличиваться в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбуждённое состояние атома стабилизируется.
Небольшими затратами энергии сопровождаются переходы электронов на более высокие энергетические подуровни внутри одного и того же уровня. Переходы электронов с энергетических подуровней одного уровня на подуровни другого уровня могут требоватьбольших затрат энергии. Поэтому возбуждённые состояния у атомов элементов первых трёх периодов Периодической системы химических элементов Д. И. Менделеева, возникающие в результате таких переходов, не могут стабилизироваться химической связью.
Определим валентности[6] атомов элементов первого и второго периодов в основном и возбуждённом состояниях.
Атом водорода имеет один электрон, поэтому его валентность всегда равна I.
В атоме гелия два электрона занимают ls-орбиталь. Переход одного из этих электронов на более высокий энергетический уровень требует больших затрат энергии, поэтому атом гелия является химически инертным.
Валентности атомов лития Li, азота N, кислорода O, фтора F и неона Neравны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в атомах этих элементов возможно только при переходе электрона на более высокий энергетический уровень:
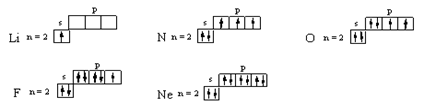
Из приведённых электронно-структурных формул видно, что валентность атома лития равна I, азота – III, кислорода – II, фтора – I, неона – 0. В атомах бериллия Be, бора B и углерода C может происходить разделение электронных пар за счёт перехода электронов с 2s-подуровня на 2р-подуровень, так как в атомах этих элементов на2р-подуровне имеются вакантные орбитали.
Такой переход на более высокий энергетический подуровень внутри данного уровня не требует большой затраты энергии, которая может быть скомпенсирована за счёт образования химической связи.
 И поэтому такие переходы осуществляются в условиях обычных химических реакций. Поэтому валентности II, III и IV, присущие атомам Be, В и С, в возбужденном состоянии более характерны, чем валентности, определяемые числом неспаренных р-электронов атомов этих элементов в основном состоянии:
И поэтому такие переходы осуществляются в условиях обычных химических реакций. Поэтому валентности II, III и IV, присущие атомам Be, В и С, в возбужденном состоянии более характерны, чем валентности, определяемые числом неспаренных р-электронов атомов этих элементов в основном состоянии:
Начиная с третьего периода, у атомов р-элементов при возбуждении электроны внешних s- и р-подуровней могут переходить на свободный d-подуровень, что приводит к увеличению числа возможных химических связей. Именно этим объясняется способность атомов фосфора Р образовывать в соединениях пять химических связей, атомов серы S – четыре или шесть, а атомов хлора Cl – три, пять и даже семь (происходит, так называемое расширение октета):
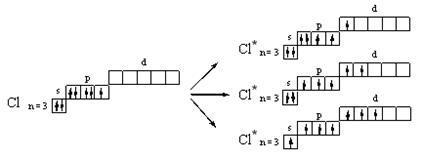
Направленность
Атомные орбитали, участвующие в образовании молекулярной орбитали, имеют различную форму и разную ориентацию в пространстве. Это обусловливает пространственную направленность ковалентных связей, образуемых атомом, поскольку соединяемые атомы стремятся к максимальному перекрыванию их электронных орбиталей.
Направленность ковалентных связей характеризуется валентными углами (углами между соседними связями). Например, молекулы СН4, NH3, H2O имеют строго определённые значения валентных углов между ковалентными связями. Длина и валентные углы ковалентных связей определяют пространственную структуру (геометрию) молекул и многоатомных ионов.
Геометрия молекулы — это взаимное пространственное расположение её атомов, которое определяется длинами связей и валентными углами. Геометрия молекулы во многом определяет физические и химические свойства вещества. Представления метода валентных связей позволяют объяснить геометрию многих молекул. Например, атомы элементов VIA-группы в основном состоянии имеют по два неспаренных р-электрона, облака которых вследствие электростатического отталкивания располагаются перпендикулярно друг другу (рис. 6 а).При образовании молекул водородных соединений H2S, H2Se и H2Te две р-орбитали атомов соответствующих элементов перекрываются с s-орбиталями атомов водорода, образуя ковалентные связи, угол между которыми близок к 90°. Исключение составляет молекула воды, у которой валентный угол Н–О–Н равен 104,5°(таблица).
Углы между связями в молекулах водородных соединений элементов IV–VIA-групп
| VIA-группа | VA-группа | IVA-группа | |||
| Формула | Валентный угол,° | Формула | Валентный угол,° | Формула | Валентный угол,° |
| H2О | 104,5 | NH3 | 107,78 | СН4 | 109,5 |
| H2S | 92,2 | РН3 | 93,3 | SiH4 | |
| H2Se | 91,0 | AsH3 | 91,5 | GeH4 | |
| H2Te | 88,5 | SbH3 | 91,3 | SnH4 |
Из рис. 6 бвидно, что близки к 90° и углы в молекулах водородных соединений элементов VA-группы (РН3, AsH3, SbH3), что хорошо согласуется с взаимным расположением трёх р-орбиталей, на которых находятся по одному неспаренному электрону. Исключением в этой подгруппе является молекула аммиака, у которой валентные углы
H–N–H равны 107,78° (табл. 1).

Рис. 6. Схема перекрывания электронных облаков в молекулах
соединений водорода с серой, селеном, теллуром (а), с фосфором,
мышьяком и сурьмой (б): пунктирными линиями изображены
атомные ns- и пр- орбитали,на которых находятся не связывающие электронные пары
Труднее объяснить с позиций метода валентных связей геометрию молекул, образуемых водородом с элементами IVA–группы. Атомы этих элементов в возбуждённом состоянии имеют по четыре неспаренных электрона: один на s-орбитали и три на р-орбиталях. При образовании гидридов СН4, SiH4, GeH4, SnH4 возникают четыре ковалентные связи. Три из них образованы за счёт перекрывания р- облаков атомов элементов четвёртой группы и s -облаков атомов водорода. Эти ковалентные связи должны иметь равную длину и энергию и располагаться под углом 90° друг к другу. Образование четвертой связи могло осуществиться за счёт перекрывания s -облаков атомов углерода и водорода, и она должна отличаться от других ковалентных связей по длине и энергии и располагаться по отношению к любой из них под углом около 125°. Однако установлено, что молекулы гидридов элементов IVA–группы имеют форму тетраэдра с углами между связями, равными 109,5°, и при этом все ковалентные связи равноценны по длине и энергии.
Таким образом, структуру молекул гидридов элементов IVA-группы (воды, аммиака и многих других молекул) невозможно объяснить с позиций только положений метода валентных связей.
Для объяснения пространственного строения молекул или многоатомных ионов с учётом направленности ковалентных связей Л. Полинг предложил концепцию гибридизации атомных орбиталей.
Не нашли, что искали? Воспользуйтесь поиском: