
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
молі будь-яких газів при однакових температурі і тиску займають однакові об’єми.
Визначимо нормальні умови для газу, як такі, при яких тиск дорівнює атмосферному, а температура – 00С:
| p 0 = 1,013 × 105 Па | (6) |
| Т 0 = 273,15 К |
За нормальних умов молярний об’єм дорівнює V m0 = 22,41×10 -3 м3/моль.
Якщо газ складається з молекул кількох різних типів, тобто є сумішшю кількох газів, то для цієї суміші справедливим є закон Дальтона:
тиск суміші газів дорівнює сумі парціальних тисків окремих газів суміші:
| р = р 1 + р 2 +... + р n, | (7) |
де р і – парціальний тиск і -ї компоненти суміші. Парціальним називають тиск, який був би створений тільки цією компонентою, якби вона займала той самий об’єм і була присутня у тій самій кількості (за відсутності інших компонент).
3. Рівняння стану ідеального газу
Для теоретичного розгляду основних закономірностей будемо користуватись фізичною моделлю, яка має назву «модель ідеального газу». В її основі лежать три припущення, які значно спрощують теоретичний аналіз фізичних процесів у газі:
1) сумарний об’єм молекул газу настільки малий, що ним можна знехтувати порівняно з загальним об’ємом газу;
2) молекули не взаємодіють між собою на відстані;
3) зіткнення молекул між собою і зі стінками посуду є абсолютно пружними.
Слід сказати, що ця модель досить вірно відображає властивості газів, які перебувають у нормальних умовах, тобто реальні гази близькі за своїми властивостями до ідеальних.
Сформульовані вище 5 законів є фактично законами для ідеальних газів, хоч вони і були отримані дослідним шляхом. Але вони були отримані за умов, коли виконуються всі три припущення, які визначають модель ідеального газу.
Три закони для ізопроцесів в результаті нескладного аналізу можна об’єднати в один закон, справедливий для будь-яких процесів (коли змінюються всі три термодинамічні параметри). В результаті отримаємо рівняння Клапейрона:
 . .
| (8) |
Якщо застосувати це рівняння до одного моля газу (V = V m), отримаємо
| pV m = RT, | (9) |
де константа R, згідно закону Авогадро, є однаковою для всіх газів. Вона має назву універсальна газова стала. Її чисельне значення можна розрахувати, якщо в рівняння (9) підставити, наприклад, нормальні умови для газів (6):
R = 8,31 Дж/(моль×К).
Якщо взяти не один моль газу, а довільну кількість молів n = т/М (для довільної маси газу т), це означатиме, що об’єм газу дорівнює V = nV m. Помноживши обидві частини рівняння (9) на n, отримаємо
| pV = nRT, | (10) |
або
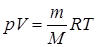 . .
| (11) |
Це універсальне рівняння, яке дозволяє досліджувати будь-які процеси у ідеальних газах зі зміною всіх параметрів стану. Воно має назву рівняння стану ідеального газу (рівняння Менделєєва-Клапейрона).
Для дослідження процесів у ідеальних газах на мікроскопічному рівні необхідно ввести ще одну фундаментальну константу – сталу Больцмана:
 = 1,38 × 10 - 23 Дж/K. = 1,38 × 10 - 23 Дж/K.
| (12) |
Скориставшись цим співвідношенням, рівняння (9) для одного моля газу можна записати у такому вигляді:
 . .
| (13) |
Концентрація молекул – це число молекул у одиниці об’єму:
 . .
| (14) |
Для одного моля газу:

|
Тому (13) можна записати, як
| p = nkT | (15) |
Це – ще одна форма рівняння стану ідеального газу.
З цього рівняння можна зробити висновок, що при сталій температурі тиск газу пропорційний концентрації його молекул.
Ще один висновок – при однакових тиску і температурі всі гази містять в одиниці об’єму однакове число молекул. Це число для нормальних умов називається числом Лошмідта і дорівнює:
 2,68 × 1025 м - 3
2,68 × 1025 м - 3
ЗАДАЧА.
У балоні ємністю 50 л знаходиться кисень при температурі 300 К. Після того, як з балону випустили деяку кількість кисню, тиск у балоні знизився на 200 Па. Визначити масу кисню, випущеного з балону. Температуру вважати незмінною.
| O2 V = 50 л Т = 300 К Т = const D р = 200 Па | СІ 5×10 – 2 м 3 | Розв'язок. Знайдемо молярну масу кисню. Його відносна молекулярна маса – це маса двох атомів кисню: Mr = 2 × 16 = 32 (а.о.м.) Ця величина чисельно дорівнює молярній масі у грамах на моль. Для переведення до одиниць СІ грами переведемо в кілограми: | |
| D m -? |
M = 32 г/моль = 32 × 10 -3 кг/моль.
Напишемо рівняння Менделєєва-Клапейрона для двох станів газу в балоні, початкового і кінцевого, позначивши відповідні величини індексами 1 і 2. При цьому величини, які в даному процесі залишаються сталими, будемо писати без індексів:
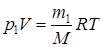 ,
,
 .
.
Віднімемо від першого рівняння друге:
 .
.
Врахуємо, що 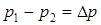 , а
, а  . Підставимо:
. Підставимо:
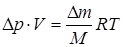 .
.
Звідси:
 .
.
Підставимо чисельні значення:  = 1,28× 10 – 4 кг
= 1,28× 10 – 4 кг
Не нашли, что искали? Воспользуйтесь поиском: