
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Строение и функции белка
Тема 2. Основы молекулярной генетики
Вопросы:
1. Строение и функции белка.
2. Модель структуры молекулы ДНК Д. Уотсона, Ф. Крика.
3. Нуклеиновые кислоты (сравнительная характеристика ДНК и РНК).
4. Генетический код и его свойства.
5. Репликация ДНК.
6. Биосинтез белка. Транскрипция.
7. Биосинтез белка. Трансляция.
8. Организация генов.
9. Упаковка генетического материала.
10. Кариотип человека.
Строение и функции белка
Белки играют важнейшую роль в жизнедеятельности любых организмов. Многообразие и сложность живой материи, по сути дела, отражают многообразие и сложность самих белков. Каждый белок имеет свою уникальную функцию, которая определяется присущими ему структурой и химическими свойствами. Некоторые белки являются ферментами, т.е. катализаторами биохимических реакций в живых организмах. Каждая химическая реакция катализируется определенным ферментом. Без участия ферментов подобные реакции не происходят вовсе, или протекают крайне медленно, что бы обеспечить саму возможность существования живых организмов. Другие белки – структурные – выполняют в организме роль строительных белков – или сами по себе (например, коллаген), или в комплексе с нуклеиновыми кислотами (нуклеопротеины), углеводами (гликопротеины) или липидами (липопротеины). Некоторые белки, вовлеченные в систему запаса и транспорта кислорода, связываются с функционально важными металлосодержащими органическими молекулами. Так, например, миоглобин и гемоглобин специфически связывают железосодержащую группировку, называемую гемом.
Белки – это большие полимерные молекулы, построенные из мономерных аминокислотных звеньев. В состав белков входят двадцать различных видов аминокислот. Все белковые аминокислоты (за исключением пролина) характеризуются общей структурой (рис. 1), обязательными элементами которой являются: аминогруппа, карбоксильная группа, водород и какой-либо радикал.
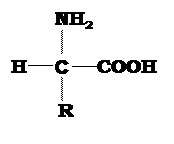
|
| Рис. 1 Структурная формула аминокислот. NH2 – аминогруппа; COOH – карбоксильная группа; (H – атом водорода); радикал R – боковая группа. |
Аминокислоты в белках связаны между собой прочными ковалентными пептидными связями, возникающими между карбоксильной группой одной аминокислоты и аминогруппой следующей кислоты. Образующийся в результате такого взаимодействия олигомер называют пептидом. Аминокислоты, входящие в состав пептида часто называют аминокислотными остатками (табл.1). Структурную основу любого пептида составляет зигзагообразный остов, образованный атомами углерода и азота.
Таблица 1
Классификация аминокислот по природе боковых групп
| Природа боковой группы | Название аминокислоты | Сокращение |
| Нейтральные | глицин | гли |
| Неполярные ароматические | триптофан | три |
| фенилаланин | фен | |
| тирозин | тир | |
| Неполярные серосодержащие | метионин | мет |
| цистеин | цис | |
| Неполярные алифатические | аланин | ала |
| лейцин | лей | |
| валин | вал | |
| изолейцин | иле | |
| пролин | про | |
| Полярные, содержащие ОН-группу | серин | сер |
| треонин | тре | |
| Полярные амиды | аспарагин | асн |
| глутамин | глн | |
| Полярные «–» заряженные | аспарагиновая кислота | асп |
| глутаминовая кислота | глу | |
| Полярные «+» заряженные | гистидин | гис |
| лизин | лиз | |
| аргинин | арг |
Не нашли, что искали? Воспользуйтесь поиском: