
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
если для реакции необходимо столкновение двух реагирующих молекул. Эта зависимость носит название кинетического закона действующих масс (К. Гулльберг, П. Воге, 1867)
Для гомогенной реакции А + В →… этот закон изображается уравнением
ν = kc A c B ,
где k – константа скорости реакции [л/(моль с)], зависящая от природы реагентов, присутствия катализатора и температуры, но не зависящая от концентрации реагентов и численно равная скорость реакции при условии сАсв = 1.
Для гетерогенной реакции А + В(ж, т) →… взаимодействие происходит лишь на поверхности конденсированного (жидкого, твердого) вещества, поэтому концентрация такого вещества не входит в выражение закона действующих масс: ν = kc A.
Для реакций, уравнения которых не отражают механизма протекания этих реакций, необходимо рассматривать каждую элементарную стадию отдельно. Тройные и более столкновения (А + В + В +… →) маловероятны, поэтому такие реакции (например, N2 + ЗН2 = 2NH3) протекают всегда в несколько элементарных стадий (А + В →). Кинетический закон действующих масс применим только к каждой из этих стадий, но не к уравнению химической реакции в целом.
Энергетика реакций
Любая реакция сопровождается выделением или поглощением энергии в форме теплоты. В исходных веществах химические связи разрываются, и на это энергия затрачивается (т. е. она при этом поглощается системой), в продуктах же, наоборот, химические связи образуются, и при этом энергия выделяется. Разность между затраченной и выделившейся энергией называется тепловым эффектом химической реакции (обозначается Q). Если затрата энергии выше, чем ее выделение, то тепловой эффект будет отрицательным, или эндо‑ эффектом (‑Q) в противном случае – положительным, или экзо ‑эффектом (+Q).
Тепловой эффект является внешним признаком реакций, в термохимических уравнениях он указывается после продуктов:
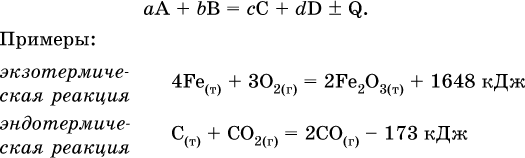
Такая запись означает, что при сгорании 4 моль железа в 3 моль кислорода с образованием 2 моль оксида железа (III) выделяется 1648 кДж теплоты, а при взаимодействии 1 моль углерода (в виде кокса) и 1 моль углекислого газа с получением 2 моль угарного газа поглощается извне 173 кДж теплоты.
Тепловые эффекты прямой и обратной реакций одинаковы по числу, но противоположны по знаку. Например, реакция

(обработка 1 моль оксида кальция водяным паром в количестве 1 моль с образованием 1 моль гидроксида кальция) сопровождается экзо ‑эффектом Q = +108 кДж, тогда как обратная реакция
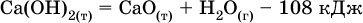
(разложение 1 моль гидроксида кальция на 1 моль оксида кальция и 1 моль водяного пара) сопровождается эндо‑ эффектом Q = ‑108 кДж.
При протекании реакций (особенно с участием газов) могут существенно меняться объем и температура реакционной системы. Если тепловой эффект определяется при постоянном давлении (1 атм для каждого газа в системе, а при отсутствии газов общее давление 1 атм) и постоянной температуре (обычно 298 К, или 25 °C), то он отвечает стандартной энтальпии реакции, характеризующей в целом всю систему (функция системы). Энтальпия реакции обозначается Δ Н °, знак Δ Н ° противоположен знаку Q:
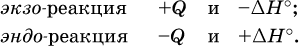
Значение Δ Н ° записывается после уравнения и отделяется от него запятой:

Реакции, протекающие с высоким экзо ‑эффектом, часто требуют только начального нагревания (инициирования), а далее протекают самопроизвольно, например процесс алюминотермии:
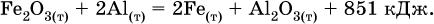
Помимо энтальпии, химическая система характеризуется еще одной функцией – стандартной энтропией реакции Δ S ° (кДж/К), связанной с неупорядоченностью системы (степенью беспорядка). Чем больше частиц в системе и чем выше ее температура, тем больше степень беспорядка. В идеальном кристалле (при абсолютном нуле температуры) степень беспорядка нулевая (идеальный порядок), в реальных твердых телах существует всегда некоторая степень беспорядка, в жидкостях она уже выше, но наибольшая степень беспорядка в газах, где молекулы не зависят друг от друга и двигаются весьма хаотично. Например, для льда, жидкой воды и водяного пара значения Δ S ° равны соответственно 0,039, 0,07 и 0,189 кДж/К.
Всякая химическая реакция, таким образом, имеет две энергетические характеристики – энтальпию Δ Н ° и энтропию Δ S °. Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет теплопередачи в окружающую среду и одновременно к увеличению степени беспорядка. Эти факторы действуют в противоположных направлениях, поэтому результирующая величина будет равна их разности:

(здесь энтропия умножена на температуру для адекватности единиц, Δ Н ° и T Δ S° приведены в килоджоулях, так как К кДж/К = кДж).
Суммарная энергетическая функция системы называется стандартной энергией Гиббса реакции Δ G°T, индекс Т подчеркивает зависимость этой величины от температуры, что очевидно из уравнения (отметим еще, что Δ Н ° и Δ S ° мало зависят от температуры).
По значениям G°T можно судить о возможности протекания реакций в направлении слева направо по химическому уравнению:
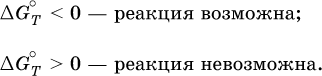
Например, синтез аммиака
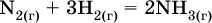
при 25 °C возможен:

а при 350 °C невозможен:
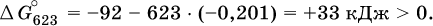
Следовательно, при 25 °C имеется принципиальная возможность получения аммиака, а при сильном нагревании системы (реакция экзотермическая, Δ Н ° = ‑92 кДж) аммиак получить не удастся. Правда, при 25 °C реакция возможна только в принципе, так как она протекает очень медленно и с малым выходом. Ускорение реакций определяется факторами химической кинетики, а увеличение степени протекания – соответствующим смещением химического равновесия.
Не нашли, что искали? Воспользуйтесь поиском: