
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристика частинок, що входять до складу атома 2 страница
2.5. Обчислення на приготування розчинів з масовою часткою речовини з кристалогідратів
Кристалогідрати – сполуки, що містять у своєму складі кристалізаційну воду. Тобто, це кристалічні речовини, до складу яких входить певне число молекул води.
Особливість розрахункових задач з кристалогідратами полягає в тому, що в розчині розчинюваною речовиною є сіль – складова кристалогідрату, а до маси розчину входить вся маса кристалогідрату з масою розчинника. Тобто, необхідно робити перерахунок з маси кристалогідрату на масу безводної солі, яка й буде розчинюваною речовиною.
ω (р.р.)= 
Приклад
У воді масою 150 г розчинили мідний купорос масою 50 г. Визначити масову частку купрум (ІІ) сульфату в одержаному розчині.
| Дано: | Розв’язання: |
| m (Н2О)р=150 г m (СuSO4∙5H2O) = =50 г | 1. Яка маса розчиненої речовини – безводного СuSO4?
СuSO4∙5H2O à CuSO4
1 моль 1 моль
М=250 г/моль М=160 г/моль
m = 250 г m = 160 г
50 г х г
х = 32 (г) - це m (р.р.)
2. Яка масова частка солі в утвореному розчині?
ω (р.р.)=  ω (СuSO4)=
ω (СuSO4)=  = 16 = 16
|
| ω % (СuSO4)-? | |
| Відповідь: масова частка купрум (ІІ) сульфату становить 16% |
Приклад
Обчислити масу мідного купоросу та води, необхідних для приготування розчину купрум (ІІ) сульфату масою 200 г з масовою часткою солі 16%.
| Дано: | Розв’язання: |
| ω (%) (СuSO4)= 16 m (СuSO4)р = 200 г | 1. ɷ (р.р.)=  m (СuSO4) =
m (СuSO4) =  m (СuSO4) =
m (СuSO4) =  = 32 (г)
2. Яка маса кристалогідрату містить 32 г безводної солі?
СuSO4 à CuSO4∙5H2O
1 моль 1 моль
М=160 г/моль М=250 г/моль
m = 160 г m = 250 г
32 г х
х = 50 (г) - це m (СuSO4∙5H2O)
3. Яка маса води потрібна?
m (Н2О) = m (СuSO4)розч - m (СuSO4∙5H2O) =
= 200 – 50 = 250 (г) = 32 (г)
2. Яка маса кристалогідрату містить 32 г безводної солі?
СuSO4 à CuSO4∙5H2O
1 моль 1 моль
М=160 г/моль М=250 г/моль
m = 160 г m = 250 г
32 г х
х = 50 (г) - це m (СuSO4∙5H2O)
3. Яка маса води потрібна?
m (Н2О) = m (СuSO4)розч - m (СuSO4∙5H2O) =
= 200 – 50 = 250 (г)
|
| m (Н2О) –? m (СuSO4∙5H2O) –? | |
| Відповідь: маса кристалогідрату 50 г, маса води 250 г. |
Приклад
Визначити масову частку натрій сульфату в розчині, одержаному при додаванні 16,1 г глауберової солі до 300 г розчину натрій сульфату з масовою часткою солі 0,2.
| Дано: | Розв’язання: |
| m (Na2SO4∙10H2O)= = 16,1 г ω 1 (Na2SO4)= 0,2 m 1(Na2SO4)р = 300 г __________________ ω2(Na2SO4) –? | 1. ω (р.р.)=  m1(Na2SO4) = ω1∙ m1(розчину)
m (Na2SO4) = 0,2 ∙ 300 = 60 (г)
2. Na2SO4 ∙10H2O à Na2SO4
1 моль 1 моль
М=322 г/моль М=142 г/моль
m = 322г m = 142 г
16,1 г х
х = 7,1 (г) - це m (Na2SO4) з кристалогідрату
3. m2(розчину) = m1(розчину) + m (кристалогідрату)
m2(Na2SO4) роз = 300 + 16,1 = 316,1 (г)
4. Яка маса розчиненої речовини в утвореному розчині?
m2(р.р.) = m1(р.р.) + m (безводної солі з кристалогідрату)
m2(Na2SO4) р.р. = 60 + 7,1 = 67,1 (г)
5. Яка масова частка утвореного розчину?
ω2(р.р.)=
m1(Na2SO4) = ω1∙ m1(розчину)
m (Na2SO4) = 0,2 ∙ 300 = 60 (г)
2. Na2SO4 ∙10H2O à Na2SO4
1 моль 1 моль
М=322 г/моль М=142 г/моль
m = 322г m = 142 г
16,1 г х
х = 7,1 (г) - це m (Na2SO4) з кристалогідрату
3. m2(розчину) = m1(розчину) + m (кристалогідрату)
m2(Na2SO4) роз = 300 + 16,1 = 316,1 (г)
4. Яка маса розчиненої речовини в утвореному розчині?
m2(р.р.) = m1(р.р.) + m (безводної солі з кристалогідрату)
m2(Na2SO4) р.р. = 60 + 7,1 = 67,1 (г)
5. Яка масова частка утвореного розчину?
ω2(р.р.)=  ω2(%) (Na2SO4)=
ω2(%) (Na2SO4)=  = 21,23 = 21,23
|
| Відповідь: масова частка солі в утвореному розчині 21,23% |
2.6. Обчислення на змішування розчинів
Задачі даного типу можна розв’язувати поетапно з використанням раніше наведених формул, а можна розв’язувати з використанням формули змішуваних розчинів:
ω(%) зміш. =  ∙100
∙100
або з використанням правила „хреста” чи „квадрата Пірсона”:



 ω1 ω2 – ω3 а (масових частин)
ω1 ω2 – ω3 а (масових частин)
 ω3
ω3
 ω2 ω1 – ω3 b (масових частин)
ω2 ω1 – ω3 b (масових частин)
Приклад
Змішали розчини сульфатної кислоти з масовими частками 10%, 25% та 32% з відповідними масами 120 г, 200 г та 350 г. Обчислити масову частку сульфатної кислоти в одержаному розчині.
| Дано: | Розв’язання: |
| ω1 = 10% ω2 = 25% ω3 = 32% m1 = 120 г m2 = 200 г m3 = 350 г | ω зміш. =  ∙100
ω4 = ∙100
ω4 =  ∙ 100%=26% ∙ 100%=26%
|
| ω4 (Н2SO4)-? | |
| Відповідь: масова частка сульфатної кислоти становить 26% |
Приклад
Які маси розчинів сульфатної кислоти з масовими частками 12% та 42% слід взяти для приготування розчину кислоти масою 600 г з масовою часткою 36%?
| Дано: | Розв’язання: |
| ω1 = 12% ω2 = 42% ω3 = 36% m3 = 600 г | І спосіб ω зміш. =  ∙100
m3 = m1 + m2
Нехай m1 = х (г), тоді m2 = 600 – х (г)
36% = ∙100
m3 = m1 + m2
Нехай m1 = х (г), тоді m2 = 600 – х (г)
36% =  ∙ 100%
х = 120 (г) – це m1,
тоді m2 = 600 – 120 = 480 (г)
ІІ спосіб ∙ 100%
х = 120 (г) – це m1,
тоді m2 = 600 – 120 = 480 (г)
ІІ спосіб
 1. 12 % 6 % 1
36 %
42 % 24 % 4
2. загальне число масових частин 1 + 4 = 5
3. маса розчину з ω = 12%
5: 1 = 600: х,
х = 120 (г).
4. маса розчину з ω1 = 42%
5: 4 = 600: у,
у = 480 (г). 1. 12 % 6 % 1
36 %
42 % 24 % 4
2. загальне число масових частин 1 + 4 = 5
3. маса розчину з ω = 12%
5: 1 = 600: х,
х = 120 (г).
4. маса розчину з ω1 = 42%
5: 4 = 600: у,
у = 480 (г).
|
| m1 =? m2 =? | |
| Відповідь: m1 = 120 г, m2 = 480 г |
Розділ ІІІ. Обчислення за рівняннями хімічних реакцій
3.1. Обчислення кількості речовини, маси чи об’єму речовини за рівнянням реакції
Приклад
Яку масу залізної окалини можна одержати при спалюванні заліза масою 33,6г?
| Дано: | Розв’язання: |
| m(Fe) = 33,6 г | І спосіб
1. М(Fe) =56 г/моль; М(Fe3O4)=232 г/моль.
3 Fe + 2 O2 à Fe3O4
2. ν (Fe) =  3.
3.  х = 0,2 моль
4. m (Fe3O4) = 232 ·0,2 = 46,4 (г).
ІІ спосіб
3 Fe + 2 O2 à Fe3O4
3 моль 1 моль
М=56 г/моль М=232 г/моль
m=168г m= 232 г
33,6 г х х = 0,2 моль
4. m (Fe3O4) = 232 ·0,2 = 46,4 (г).
ІІ спосіб
3 Fe + 2 O2 à Fe3O4
3 моль 1 моль
М=56 г/моль М=232 г/моль
m=168г m= 232 г
33,6 г х
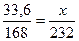 ; ; 
|
| m (Fe3O4)-? | |
| Відповідь: маса окалини 46,6 г. |
3.2.Розв’язування задач на домішки
Під час хімічних виробництв використовують сировину, яка в основному не являє собою чисту речовину, а містить різноманітні домішки. Ці домішки в процесі виробництва участі не беруть. Тому необхідно провести розрахунки, за якими обчислити масу чистої речовини, яка і буде брати участь в хімічному процесі.
Особливість розв’язування задач даного типу полягає в тому, що слід з’ясувати, що є технічною речовиною, чистою речовиною, а що є домішками. Технічна речовина – це речовина, в якій корисний компонент, забруднений домішками. Визначивши компоненти, користуємось опорними формулами.
 |
Технічна речовина
 чиста речовина
чиста речовина
m(тex) = m (чист. реч.) + m(дом); m (чист. реч.) = m(тex) – m(дом)
ω%(дом.) =  ; ω% (чист. реч.) =
; ω% (чист. реч.) = 
ω%(дом.) + ω% (чист. реч.) = 100%
Приклад
Який об’єм водню виділиться при дії хлоридної кислоти на технічний алюміній масою 1,2 г, якщо масова частка домішок, що не реагують з кислотою, 10%.
| Дано: | Розв’язання: |
| m(Al тех)=1,2 г ω%(дом.)=10% | М(Аl)=27 г/моль; Vm=22,4л/моль
1. m =  2. m(Al)=1,2 – 0,12=1,08 (г)
3. υ(Al)=1,08:27=0,04 (моль)
4. 6 HCl + 2 Al à 2 AlCl3 + 3 H2
2. m(Al)=1,2 – 0,12=1,08 (г)
3. υ(Al)=1,08:27=0,04 (моль)
4. 6 HCl + 2 Al à 2 AlCl3 + 3 H2
 2 моль 3 моль
0,04 моль х
Х= 2 моль 3 моль
0,04 моль х
Х=  5. Який об’єм водню? V(H2)= 22,4·0,06=1,344 (л)
5. Який об’єм водню? V(H2)= 22,4·0,06=1,344 (л)
|
| V(H2)-? | |
| Відповідь: 1,344 л водню |
3.3.Розв’язування задач на вихід продукту від теоретично можливого
Особливість цих задач полягає в тому, що в умові зазначається маса або об’єм вихідної речовини та практична маса чи об’єм продукту реакції. На основі цих даних необхідно обчислити масову або об’ємну частку виходу продукту реакції за відношенням до теоретично можливого.
Відношення маси практично одержаного продукту до маси речовини, яку повинні одержати теоретично, називають масовою часткою виходу продукту і позначають грецькою літерою η (читається ета).
Під час одержання продукту в газоподібному чи рідкому станах обчислюють об’ємну частку виходу продукту, яку позначають літерою φ (читається фі).
η (Х) =  ; φ(Х) =
; φ(Х) = 
Приклад
При випалюванні залізного колчедану масою 96 г одержали ферум (ІІІ) оксид масою 60 г. Обчислити вихід продукту реакції за відношенням до теоретичного.
| Дано: | Розв’язання: |
| m (FeS2) = 96 г m(Fe2O3) = 60 г | М (FeS2) =120 г/моль; М (Fe2O3) = 160 г/моль
1. ν (FeS2) = 96:120 =0,8 моль
2. 4 FeS2 + 11 О2 à 2 Fe2O3 + 8 SO2
ν (Fe2O3) =  (моль)
3. m(Fe2O3)=64 г
4. η (Fe2O3) = (моль)
3. m(Fe2O3)=64 г
4. η (Fe2O3) = 
|
| η (Fe2O3)-? | |
| Відповідь: 93,75% |
3.4. Розв’язування задач на надлишок однієї з реагуючих речовин
Особливість задач даного типу полягає в тому, що в умові зазначається маса чи об’єм обох реагуючих речовин, одна з яких дається з кількості, більшій, ніж це необхідно для реакції (тобто, в надлишку). Під час проведення реакції частина такої речовини залишається в реакційній суміші після реакції, тому що не прореагує повністю. Для обчислення продукту реакції необхідно знати масу чи об’єм речовини, що прореагує повністю. Саме за даними цієї речовини (вважається, що вона знаходиться в недостачі) і будуть проводитися обчислення, необхідні для продукту реакції.
ν (X) =  ; ν (X) =
; ν (X) =  ; k =
; k =  ;
;
M(прод)= k∙М(пр)∙υ (пр); V(прод)= k∙Vm∙υ (пр)
Приклад
Який об’єм водню виділиться при взаємодії алюмінію масою 2,16 г з розчином, що містить 9,6 г хлоридної кислоти?
| Дано: | Розв’язання: |
| m (Al) = 2,16 г m (HCl) = 9,6 г | І спосіб
1. υ (Al) =  (моль); υ (HCl) = (моль); υ (HCl) = 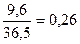 (моль)
2. 2Al + 6HCl à 2AlCl3 + 3Н2↑
3. кількість речовини хлоридної кислоти, щоб повністю прореагував весь алюміній кількістю речовини 0,08 моль
2: 6 = 0,08: х; х = 0,24 (моль)
4. У нас за умовою кислоти 0,26 моль, а потрібно 0,24 моль. Отже в надлишку саме HCl. Тоді алюміній у недостачі.
Подальші розрахунки проводимо за тією речовиною, яка в недостачі, тобто – за алюмінієм.
5. 2: 3 = 0,08: у; у = 0,12 (моль)
6. V(H2) = 0,12 ∙ 22,4 = 2,688 (л).
ІІ спосіб
2. 2Al + 6HCl à 2AlCl3 + 3Н2↑
3. Обчислюємо коефіцієнти пропорційності:
k (Al) = (моль)
2. 2Al + 6HCl à 2AlCl3 + 3Н2↑
3. кількість речовини хлоридної кислоти, щоб повністю прореагував весь алюміній кількістю речовини 0,08 моль
2: 6 = 0,08: х; х = 0,24 (моль)
4. У нас за умовою кислоти 0,26 моль, а потрібно 0,24 моль. Отже в надлишку саме HCl. Тоді алюміній у недостачі.
Подальші розрахунки проводимо за тією речовиною, яка в недостачі, тобто – за алюмінієм.
5. 2: 3 = 0,08: у; у = 0,12 (моль)
6. V(H2) = 0,12 ∙ 22,4 = 2,688 (л).
ІІ спосіб
2. 2Al + 6HCl à 2AlCl3 + 3Н2↑
3. Обчислюємо коефіцієнти пропорційності:
k (Al) =  =0,04; k (HCl) = =0,04; k (HCl) =  =0,044
4. Коефіцієнт пропорційності менший у алюмінію, отже знаходимо об’єм водню саме за ним:
V(H2) = 0,04 ∙22,4∙3=2,688 (л) =0,044
4. Коефіцієнт пропорційності менший у алюмінію, отже знаходимо об’єм водню саме за ним:
V(H2) = 0,04 ∙22,4∙3=2,688 (л)
|
| V(H2) -? | |
| Відповідь: об’єм утвореного водню становить 2,688 л |
Особливості розв’язування задач на надлишок за участю солей багатоосновних кислот
Особливість цих задач полягає у тому, що в залежності від кількісних співвідношень кислот з лугами можуть утворюватись різні типи солей.
Для ортофосфатної кислоти:
Н3РО4 + NaOH à NaH2PO4 + H2O (співвідношення 1: 1)
Н3РО4 + 2NaOH à Na2HPO4 + 2H2O (співвідношення 1: 2)
Н3РО4 + 3NaOH à Na3PO4 + 3H2O (співвідношення 1: 3)
Для двохосновних кислот (наприклад, Н2SО4)
Н2SО4 + KOH à KНSО4 + H2O (співвідношення 1: 1)
Н2SО4 + 2KOH à K2SО4 + H2O (співвідношення 1: 2)
Приклад
До розчину, що містить 16 г натрій гідроксиду, додали розчин, що містить 19,6 г ортофосфатної кислоти. Розчин випарили. Обчислити маси утворених солей.
| Дано: | Розв’язання: |
| m (NaOH) = 16 г m (Н3РО4) = 19,6 г | 2. υ (NaOH) =  (моль); υ (Н3РО4) = (моль); υ (Н3РО4) =  (моль)
3. υ (NaOH): υ (Н3РО4) = 0,4: 0,2 = 2: 1
Сіль двозаміщена.
4. Н3РО4 + 2NaOH à Na2HPO4 + 2H2O
5. кількість речовини утвореної солі
1: 1 = 0,2: х
х = υ (Na2HPO4)= 0,2 (моль)
6. маса утвореної солі
M (Na2HPO4) = 0,2 ∙ 142 = 28,4 (г) (моль)
3. υ (NaOH): υ (Н3РО4) = 0,4: 0,2 = 2: 1
Сіль двозаміщена.
4. Н3РО4 + 2NaOH à Na2HPO4 + 2H2O
5. кількість речовини утвореної солі
1: 1 = 0,2: х
х = υ (Na2HPO4)= 0,2 (моль)
6. маса утвореної солі
M (Na2HPO4) = 0,2 ∙ 142 = 28,4 (г)
|
| m (солей) -? | |
| Відповідь: маса утвореного натрій гідрофосфату 28,4 г. |
Приклад
До розчину, що містить 44 г натрій гідроксиду, додали розчин, що містить 39,2 г ортофосфатної кислоти. Розчин випарили. Обчислити маси утворених солей.
| Дано: | Розв’язання: |
| m (NaOH) = 44 г m(Н3РО4)= 39,2 г | 2. υ (NaOH) =  (моль); υ (Н3РО4) = (моль); υ (Н3РО4) =  (моль)
3. υ (NaOH): υ (Н3РО4) = 1,1: 0,4 = 2,75: 1
Утворюється двозаміщена сіль і трохи гідрофосфату.
4. Н3РО4 + 2NaOH à Na2HPO4 + 2H2O
Na2HPO4+ NaOH à Na3PO4 + H2O
5. кількість речовини лугу яка прореагувала з кислотою
1: 2 = 0,4: х; х = 0,8 (моль)
6. кількість речовини лугу в надлишку
υ (NaOH) = 1,1 – 0,8 = 0,3 (моль)
7. кількість речовини утвореної солі Na2HPO4
1: 1 = 0,4: у; у= 0,4 (моль)
8. кількість речовини гідрофосфату натрію яка прореагувала з надлишком лугу
1: 1 = 0,3: у2; у2= 0,3 (моль)
9.кількість речовини гдрофосфату натрію яка залишилась
υ (Na2HPO4) = 0,4 – 0,3 = 0,1 (моль)
10. кількість речовини ортофосфату натрію яка утворилась
1: 1 = 0,3: у3; у3= 0,3 (моль)
11. маса утворених солей
M (Na2HPO4) = 0,1 ∙ 142 = 14,2 (г)
m (Na3PO4) = 0,3 ∙ 164 = 49,2 (г) (моль)
3. υ (NaOH): υ (Н3РО4) = 1,1: 0,4 = 2,75: 1
Утворюється двозаміщена сіль і трохи гідрофосфату.
4. Н3РО4 + 2NaOH à Na2HPO4 + 2H2O
Na2HPO4+ NaOH à Na3PO4 + H2O
5. кількість речовини лугу яка прореагувала з кислотою
1: 2 = 0,4: х; х = 0,8 (моль)
6. кількість речовини лугу в надлишку
υ (NaOH) = 1,1 – 0,8 = 0,3 (моль)
7. кількість речовини утвореної солі Na2HPO4
1: 1 = 0,4: у; у= 0,4 (моль)
8. кількість речовини гідрофосфату натрію яка прореагувала з надлишком лугу
1: 1 = 0,3: у2; у2= 0,3 (моль)
9.кількість речовини гдрофосфату натрію яка залишилась
υ (Na2HPO4) = 0,4 – 0,3 = 0,1 (моль)
10. кількість речовини ортофосфату натрію яка утворилась
1: 1 = 0,3: у3; у3= 0,3 (моль)
11. маса утворених солей
M (Na2HPO4) = 0,1 ∙ 142 = 14,2 (г)
m (Na3PO4) = 0,3 ∙ 164 = 49,2 (г)
|
| m (солей) -? | |
| Відповідь: маса утвореного натрій гідрофосфату 14,2 г, а натрій ортофосфату 49,2 г. |
3.5. Обчислення за термохімічними рівняннями.
Термохімічними називаються рівняння хімічних реакцій, в яких зазначений тепловий ефект реакції.
Тепловим ефектом реакції (∆Н0) називається кількість теплоти, яка поглинається чи виділяється під час хімічної реакції. Тепловий ефект реакції записується після хімічного рівняння і відділяється від нього крапкою з комою. Значення ∆Н стосується того числа молів речовин, яке зазначене рівнянням реакції.
Екзотермічними називаються хімічні реакції, які відбуваються з виділенням теплоти. При таких процесах значення ∆Н має від’ємне значення. Хімічні реакції, які відбуваються з поглинанням теплоти, називаються ендотермічними.. Значення ∆Н – додатнє.
Теплота утворення (кДж/моль) – це тепловий ефект реакції утворення 1 моль речовини зі стійких простих речовин при тиску 101,3 кПа та температурі 298 К. Слід пам’ятати, що тепловий ефект реакції утворення простих речовин за стандартних умов приймається рівним 0.
Закон Гесса:
Тепловий ефект хімічної реакції залежить від стану вихідних речовин і кінцевих продуктів, але не залежить від проміжних стадій реакції.
Із закону Гесса витікає, що тепловий ефект реакції (∆Н0) дорівнює різниці сум теплових ефектів реакцій утворення кінцевих продуктів реакції (∆Н0кін) і вихідних речовин (∆Н0вих):
∆Н0 = ∑ ∆Н0 кін – ∑ ∆Н0вих
Приклад
Скільки теплоти виділиться при згоранні водню об’ємом 67,2 л, якщо тепловий ефект реакції становить 571,6 кДж?
| Дано: | Розв’язання: |
| V (Н2) = 67,2 л ∆Н0 = -571, 6 кДж | 2 H2 + O2 à 2 H2O + 571,6 кДж
2 моль
Vm=22,4л/моль
V=44,8 л 571,6 кДж
67,2 л х
х =  = 857,4 (кДж) = 857,4 (кДж)
|
| q -? | |
| Відповідь: 857,4 кДж |
Приклад
Скласти термохімічне рівняння, якщо відомо, що при згорянні магнію масою 4г виділяється 102,4 кДж теплоти.
| Дано: | Розв’язання: |
| m (Mg) = 4 г q = 102,4 кДж | 2 Mg + O2 à 2 MgO + x кДж
2 моль
M=24 г/моль
m=48 г х кДж
4 л 102,4 кДж
х =  = 1228,8 (кДж) = 1228,8 (кДж)
|
| ∆Н0 -? | |
| Відповідь: ∆Н0 = - 1228,8 кДж |
Приклад
Обчислити тепловий ефект реакції, що описується рівнянням С2Н6О (г) + 3О2 (г) à 2СО2 (г) + 3Н2О, якщо теплоти утворення С2Н6О, СО2 та Н2О відповідно становлять -277 кДж/моль; -393,3 кДж/моль та -286,2 кДж/моль.
| Дано: | Розв’язання: |
| ∆Н0(С2Н6О) = -277 кДж/моль ∆Н0(СО 2) = -393,3 кДж/моль ∆Н0(Н2О) = -286,2 кДж/моль | С2Н6О (г) + 3О2 (г) à 2СО2 (г) + 3Н2О ∆Н0 = ∑ ∆Н0 кін – ∑ ∆Н0вих ∆Н0=(2∙(-393,3) + 3∙(-286,2))- (1∙(-277)+3∙0)= = (-786,6 – 858,6) + 277 = -1368,2 кДж |
| ∆Н0 -? | |
| Відповідь: ∆Н0 = - 1368,2 кДж |
3.6. Розв'язування задач на суміші
Суміші – це системи, в яких співвідношення реагуючих компонентів може бути різним. Тому при розв’язуванні задач на знаходження компонентів сумішей потрібно писати не сумарне рівняння реакції, а для кожного компонента суміші окремо. Якщо в суміші є більше, ніж два компоненти, то для кожного третього компонента суміші необхідна додаткова умова в задачі.
Приклад
При розчиненні у хлоридній кислоті сплаву алюмінію з цинком масою 6,66 г виділилось 3,024 л водню. Визначити масу кожного металу у суміші.
| Дано: | Розв’язання: |
| m (Al + Zn) = 6,66 г V (H2) = 3,024 л | І спосіб
1.Нехай m (Al) = х (г), тоді m (Zn) = 6,66 – х (г)
2. кількості реагуючих речовин
υ (Al) =  (моль) υ (Zn) = (моль) υ (Zn) =  (моль)
3. кількість речовин водню яка виділяється
υ (H2) = (моль)
3. кількість речовин водню яка виділяється
υ (H2) =  = 0,135 (моль)
4. 2 Al + 6 HCl à 2 AlCl3 + 3H2↑
Zn + 2 HCl à ZnCl2 + H2↑
5. кількість моль водню який виділиться при взаємодії хлоридної кислоти з алюмінієм
2: 3 = = 0,135 (моль)
4. 2 Al + 6 HCl à 2 AlCl3 + 3H2↑
Zn + 2 HCl à ZnCl2 + H2↑
5. кількість моль водню який виділиться при взаємодії хлоридної кислоти з алюмінієм
2: 3 =  : υ1 (H2); υ1 (H2)= : υ1 (H2); υ1 (H2)= 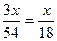 (моль)
6. кількість моль водню який виділиться при взаємодії хлоридної кислоти з цинком
1: 1 = (моль)
6. кількість моль водню який виділиться при взаємодії хлоридної кислоти з цинком
1: 1 =  : υ2 (H2); υ2 (H2)= : υ2 (H2); υ2 (H2)=  (моль)
7. маса алюмінію в суміші (моль)
7. маса алюмінію в суміші
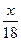 + +  = 0,135
65х + 119,88 – 18х = 157,95 х = 0,81 (г)
8. маса цинку в суміші?
m (Zn) = 6,66 – 0,81 = 5,85 (г)
ІІ спосіб
1.Нехай m (Al) = х (г), тоді m (Zn) = у (г)
2. кількості реагуючих речовин
υ (Al) = = 0,135
65х + 119,88 – 18х = 157,95 х = 0,81 (г)
8. маса цинку в суміші?
m (Zn) = 6,66 – 0,81 = 5,85 (г)
ІІ спосіб
1.Нехай m (Al) = х (г), тоді m (Zn) = у (г)
2. кількості реагуючих речовин
υ (Al) =  (моль) υ (Zn) = (моль) υ (Zn) =  (моль)
3. кількість речовин водню який виділяється
υ (H2) = (моль)
3. кількість речовин водню який виділяється
υ (H2) =  = 0,135 (моль)
4. 2 Al + 6 HCl à 2 AlCl3 + 3H2↑
Zn + 2 HCl à ZnCl2 + H2↑
5. кількість моль водню який виділиться при взаємодії хлоридної кислоти з алюмінієм
2: 3 = = 0,135 (моль)
4. 2 Al + 6 HCl à 2 AlCl3 + 3H2↑
Zn + 2 HCl à ZnCl2 + H2↑
5. кількість моль водню який виділиться при взаємодії хлоридної кислоти з алюмінієм
2: 3 =  : υ1 (H2); υ1 (H2)= : υ1 (H2); υ1 (H2)= 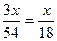 (моль)
6. кількість моль водню який виділиться при взаємодії хлоридної кислоти з цинком
1: 1 = (моль)
6. кількість моль водню який виділиться при взаємодії хлоридної кислоти з цинком
1: 1 =  : υ2 (H2); υ2 (H2)= : υ2 (H2); υ2 (H2)=  (моль)
7. маса речовин у суміш (моль)
7. маса речовин у суміш
 х + у = 6,66; х + у = 6,66;
 + +  = 0,135; = 0,135;
 у = 6,66 – х, у = 6,66 – х,
 + +  = 0,135;
х = 0,81 (г), у = 5,85 (г) = 0,135;
х = 0,81 (г), у = 5,85 (г)
|
| m (Al) -? m (Zn) -? | |
| Відповідь: m (Al) = 0,81 г; m (Zn) = 5,85 г. |
Розділ 1V. Розв'язування задач на встановлення формул органічних сполук
Не нашли, что искали? Воспользуйтесь поиском: