
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристика ковалентной связи
Механизм образования ковалентной связи носит обменный характер. Атомы используют для образования общей электронной пары неспаренные (валентные) электроны.
Ковалентная связь имеет свойства: насыщаемость, гибридизация, направленность и поляризуемость.
Насыщаемость связи
Вследствие насыщаемости связи молекулы имеют определенный состав. Ковалентная связь осуществляется валентными электронами внешнего слоя s – и р – орбиталей и d – орбитали внутреннего незавершенного слоя.
Необходимо научиться определять положение валентных электронов в атоме и их число в нормальном и возбужденном состоянии атома.
Кроме этого, важно определять степени окисления элементов, что помогает правильно составлять формулы химических соединений.
ВАЛЕНТНОСТЬ – это свойство атомов образовывать химические связи. Она определяется числом связей атомов в молекуле.
Валентные возможности атомов определяются количеством неспаренных электронов, которые могут принимать участие в образовании связей.
Пример. Определить валентность азота в молекуле аммиака NН3.
Электронная формула азота: 714N 1s2 2s2 2р3
| ¯ | | | |
Электронная формула водорода: 11Н 1s1
| |
Схема молекулы аммиака:
 Н Н
Н Н
: N Н N __________ Н

Н Н
Точками изображаются валентные электроны. В молекуле NН3 участвуют три неспаренных электрона азота. Они образуют связь (общие электронные пары с водородом) с водородом. Таким образом, валентность азота равна 3 (три связи), валентность водорода равна 1 (одна связь). Валентность не имеет знака.
СТЕПЕНЬ ОКИСЛЕНИЯ - условный заряд, который приобрел бы атом при полном смещении связующих электронов к более электроотрицательному атому. Степень окисления может быть положительной и отрицательной величиной, а также равняться 0.
Условно степень окисления можно определить по числу неспаренных электронов, которые может отдать или присоединить атом. Если атом отдает электроны, он приобретает положительный заряд, равный числу отданных электронов. Если же атом принимает электроны, то он получает отрицательный заряд.
Пример. Определить степень окисления натрия, электронная формула:11Nа 1s2 2s2 2p6 3s1
| |
Число неспаренных электронов равно 1. Значит, натрий как металл может отдать один электрон и степень окисления его будет равна +1.
Na0 – 1ē = Na+.
Общие правила определения числа валентных электронов
Зная число неспаренных электронов (валентных), можно определить валентность и степень окисления.
- Валентные электроны находятся на внешнем слое и внутреннем незавершенном (т.е. на d -подуровне находится меньше 10 электронов).
- Для определения числа валентных электронов нужно написать электронную формулу, графически изобразить валентные слои в нормальном состоянии.
- Число валентных электронов может быть увеличено за счет распаривания валентной пары, когда атом переходит в возбужденное состояние. В возбужденном состоянии электроны переходят внутри слоя на более удаленный подуровень в свободные орбитали:
s ® p p ® d s ® d d ® f.
- Подсчитывается число неспаренных электронов в нормальном и возбужденном состоянии и определяется валентность и степень окисления.
Пример. Определить валентность и степень окисления серы.
а) электронная формула серы:
16S 1s2 2s2 2p6 3s2 3p4;
б) графическое изображение валентного слоя в нормальном состоянии атома:
16S 3s2 3p4 3d
| ¯ | ¯ | | |
в) возбужденные состояния атома:
16S* 3s2 3p3 3d1
| ¯ | | | | |
16S** 3s1 3p3 3d2
| | | | | | |
Вывод. У серы в нормальном состоянии 2 неспаренных электрона, в первом возбужденном состоянии - 4, во втором - 6. Следовательно, валентность серы равна 2, 4, 6. Столько связей образует сера в различных соединениях.
H2S SO2 SO3


 H O O
H O O



 S S O S
S S O S
 H O O
H O O
Степень окисления серы в простом веществе равна нулю, а в соединениях –-2, +4, +6:
S0 + Н20 = Н2+S-2 S0 + O20 = S+4O2-2 S0 + 3Cl20 = S+6Cl6-1
S0 + 2ē ® S-2 S0 – 4ē ® S+4 S0 – 6ē ® S+6.
Пример. Определить валентность и степень окисления кислорода.
а) электронная формула:
8O 1s2 2s2 2p4;
б) графическое изображение валентного слоя в нормальном состоянии:
8O 2s2 2p4
| ¯ | ¯ | | |
 в) возбужденное состояние у кислорода отсутствует, так как на внешнем слое нет свободных орбиталей, и переход электронов на следующий энергетический уровень (3-й) нeвозможен в процессе химической реакции. Н
в) возбужденное состояние у кислорода отсутствует, так как на внешнем слое нет свободных орбиталей, и переход электронов на следующий энергетический уровень (3-й) нeвозможен в процессе химической реакции. Н
 Вывод. Валентность кислорода равна2. Н2О О
Вывод. Валентность кислорода равна2. Н2О О
Н
Степень окисления кислорода может быть положительной:
О – 2ē = О+2, О+2F2-1.
Это единственное соединение, где кислород проявляет положительную степень окисления.
Кислород может иметь и отрицательную степень окисления:
О + 2ē = О-2, 2Н2 + О2 = 2Н2+1О-2.
В большинстве соединений он имеет С.О. -2. В О2 и О3 степень окисления равна 0. В перекисных соединениях С.О. кислорода равна –1 (Н+ - О- - О- - Н+).
Пример. Определить валентность и степень окисления железа.
а) электронная формула:
26Fe 1s2 2s2 2p6 3s2 3p6 3d6 4s2;
б) графическое изображение валентного слоя в нормальном состоянии:
26Fe 3d6 4s2
| ¯ | | | | | ¯ |
в) возбужденное состояние:
26Fe* 3d6 4s1 4p1
| ¯ | | | | | | |
Возбужденное состояние у железа возможно только при переходе электронов внутри четвертого слоя. На 3-м слое нет свободных орбиталей. Железо относится к элементамd- семейства, поэтому у него валентные электроны расположены на внешнем s- и внутреннем d - подуровнях. Валентность железа переменная. Она равна 2 за счет электронов S- внешнего слоя и 3, 4, 5, 6 за счет электронов d - подуровня.
Степень окисления у металлов всегда положительная, так как на внешнем слое у них от 1 до 3-х электронов. В нашем случае степень окисления железа равна: + 2, + 3, + 4, + 5, + 6.
Пример. Fe0 - 2ē = Fe+2, Fe0 - 6ē = Fe+6.
Составление формул химических соединений
на основании степени окисления
В молекулах химических соединений сумма положительных зарядов равна сумме отрицательных. Молекула нейтральна.
На основании этого правила составляется формула соединения.
Пример. Написать формулы соединений алюминия с кислородом, хлором. Определяем число валентных электронов у алюминия:
13Al 1s2 2s2 2p6 3s2 3p1 13Al* … 3s1 3p2
| ¯ | | | | |
Аl - металл, поэтому он будет проявлять положительную степень окисления, отдавая электроны кислороду и хлору.
Определяем число валентных электронов у кислорода и хлора.
8О 1s2 2s2 2p4 17Сl 1s2 2s2 2p6 3s2 3p5
| ¯ | ¯ | | | ¯ | ¯ | ¯ | |
Кислород и хлор - неметаллы, по отношению к алюминию они будут проявлять отрицательную степень окисления.
8О0 + 2ē = О-2,
17Сl0 + 1ē = Сl-.
Составление формул:
Аlx+3OY-2, Аlx+3 СlY-.
Число положительных зарядов алюминия в оксиде и в хлориде алюминия должно быть равно числу отрицательных зарядов кислорода и хлора. Для нахождения Х и У определяем наименьшее кратное, которое делится на 3 и 2 в оксиде АlxOY.
Это 6, тогда: Х = 6: 2 = 3 У = 6: 3 = 2 ® Al2+3О3-2.
В хлориде AlxСlY наименьшее кратное равно 3, тогда:
X = 3: 1 = 3 У = 3: 1 = 3 ® Al+3Сl3-.
Полярность – поляризуемость связи
По характеру расположения связующих электронов различают полярную, неполярную и ионную типы связей.
Для характеристики типа связей введено понятие электроотрицательности (Э.О.) Это относительная величина. Электроотрицательность лития принята за единицу.
Э.О. некоторых элементов:
Элемент Li Na K Mg Fe H S O Cl F
Э.О. 1,00 1,01 0,91 1,23 1,64 2,10 2,60 3,50 2,83 4,10
Чем больше Э.О., тем легче атом данного элемента притягивает электроны и заряжается отрицательно. Атом с меньшим значением Э.О. приобретает положительный заряд, так как он стремится к отдаче электронов.
Тип химической связи зависит от того, какова разность Э.О. элементов, образующих молекулу. У элементов с одинаковой Э.О., проявляется ковалентная неполярная связь, например, в молекулах H2, Cl2, O2 и др.
Если элементы имеют различную электроотрицательность, то образующаяся связь называется ковалентной полярной. Этот тип связи наиболее распространен. Например, HСl, НВr, H2O и др.
Если разница в Э.О. > 2,8, то связь считается ионной. Таким образом, ионную связь следует рассматривать как крайний случай полярной ковалентной связи.
В зависимости от характера распределения электронной плотности в молекулах различают неполярные и полярные (диполи) молекулы.
Диполь – система из двух зарядов, равных по величине и противоположных по знаку.
В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают, поэтому связь в таких молекулах симметрична.
Например, в молекулах водорода, хлора, кислорода и др.
Н 1s1 + Н 1s1 ® H2 Н: Н
| ¯ | ¯ | | ¯ |
s s
Полярные молекулы являются диполями. Полярность диполя определяется величиной дипольного момента m, который равен произведению зарядов d на длину диполя: m = . d
В неполярной молекуле m = 0.
Электронная плотность связующих электронов в полярных молекулах смещается к более электроотрицательному атому. Например, в молекуле НF связующее электронное облако смещено к фтору, поэтому у водорода появляется избыточный положительный заряд d +, а у фтора отрицательный d -. Такие заряды называются эффективными. Считается, что атом водорода в НF поляризован положительно, а атом фтора – отрицательно.
Пример.
Н 1s1; F …3s2 3p5 Hd+ Fd-

| ¯ | ¯ | ¯ | |
s p
Связующая электронная плотность может быть смещена под действием внешнего электрического поля. Происходит поляризация связи, молекула становится более полярной. Поляризация влияет на реакционную способность молекул.
Направленность связи. Строение молекул
Так как образование связей за счет общих электронных пар осуществляется электронами разных энергетических состояний, возможно объединение связующих электронов s-, p- и d-состояния. При этом возникают смешанные А.О., так называемые гибридные. Поэтому, несмотря на различные формы А.О., принимающих участие в образовании гибридных облаков, полученные связи оказываются равноценными. Связь, образованная с участием гибридных А.О., более прочная, чем связь, возникшая за счет отдельных s-, p- и d-электронов.
Пример образования гибридных А.О. атома углерода 126С:
612С 1s2 2s2 2p2 6С* 2s1 2p3
| ¯ | | | | | | |
Схема гибридизации:
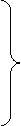 1s + 3p ® 4sp3
1s + 3p ® 4sp3
1s + 2p ® 3sp2 Гибридизированные А.О.
1s + 1p ® 2sp
Таким образом, в атоме углерода могут образоваться sp3-, sp2-, sр- гибридизированные А.О.
Способы перекрывания А.О. бывают различными. В зависимости от этого различают s- и p- связи. Связь осуществляется в том направлении, в котором перекрывание А.О. максимально.
s - связи образуются при перекрывании электронных облаков по линии, связывающей центры атомов.
p - связи образуются при перекрывании электронных облаков перпендикулярно линии, связывающей центры атомов.
s – орбитали симметричны, поэтому образуют только s связи. Перекрывание s – p и p – p дают s- и p- связи.
Примеры: а) образование молекулы Сl2.
Электронная формула 17Сl:
17Сl 1s2 2s2 2p6 3s2 3p5
Графическое изображение валентного слоя:
17Сl … 3s2 3p5
| ¯ | ¯ | ¯ | |
Образование молекулы.
17Сl … 3s2 3p5
| ¯ | ¯ | ¯ | |
17Сl … 3s2 3p5 Cl - Cl
 ¯ ¯
| ¯ | ¯ | ¯ |
s - связь
p p
б) образование молекулы О2.
8О 1s2 2s2 2p4
8О … 2s2 2p4
| ¯ | ¯ | | |
 Схема образования молекулы.
Схема образования молекулы.
8О … 2s2 2p4 О = О
| ¯ | ¯ | | |
p p
 ¯ ¯
| ¯ | ¯ | ¯ |
s - связь p - связь
В молекуле кислорода р – электроны перекрываются в двух направлениях: вдоль оси, соединяющей ядра (s - связь) и перпендикулярной оси, соединяющей ядра (p - связь).
Образование молекулы HF.
1Н 1s1 Hd+ - Fd-
| | ||||
 ¯ ¯
| ¯ | ¯ | ¯ |
9F…2s2 2p5 s p
s -связь
При перекрывании s – s, s – p и p – p орбиталей образуются линейные молекулы, угол связи 180°.
Если образуется несколько связей, то возникают угловые и другие пространственные конфигурации (пирамида, тетраэдр и т.п.) молекул.
Примеры: а) образование молекулы Н2О.
1Н 1s1 1Н 1s1
| | |
| ¯ | ¯ | ¯ | ¯ |
8О…2s2 2p4
s – р связь расположена под углом 104°28¢. Образуется угловая молекула.

 О О
О О
Н Н Н Н
104° 28¢
Перекрывание гибридизированных А.О. также происходит в различных направлениях с образованием s связей;
б) образование молекулы СН4.
6С 1s2 2s2 2р2
6С … 2s2 2р2
| ¯ | | |
6С* … 2s1 2р3 – возбужденное состояние атома С.
| | | | |
Гибридизация А.О.
1s + 3р ® 4sр3
1 + 3 ® 4
Н Н sp3 Образуется
тетраэдрическая молекула
С
Н Н
109,28°
в) образование молекулы NH3.
7N … 2s2 2p3 4sp3 - гибридных А.О.
| ¯ | ¯ | ¯ | ¯ |
| | | |
Н1s1 Н1s1 Н1s1
Н Одна sp3 гибридная А.О.
оказывается несвязывающей и
N направлена к вершине пирамиды.
Н Н
107,3°
Не нашли, что искали? Воспользуйтесь поиском: