
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Свойства ковалентной связи
Длина связи – это межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина.
Энергия связи – определяется количеством энергии, которое необходимо для разрыва связи.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей.
Например: Н – неспаренный ℮ - 1 связь Н — Н;
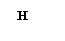

С* - 4 неспаренных ℮ - 4 связи Н - С – Н;
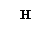

Направленность – обусловливает пространственную структуру молекул, т.е. их геометрию (форму). Рассмотрим это на примере образования молекул Н2О (рис.) и NH3 (рис.5.)
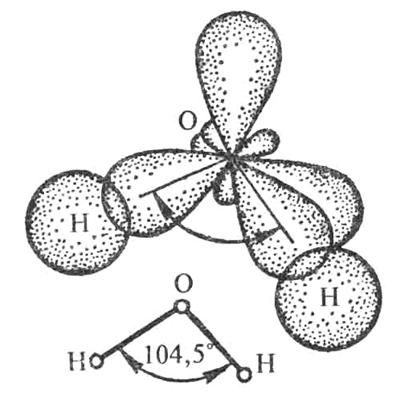
.Рис.4. Схема образования химических связей в молекуле H2O
Форма молекулы воды – угловая.
О+7 1s22s22p4 – 2 неподеленные пары, 2 неспаренных электрона.
ÐНОН = 104,5°.
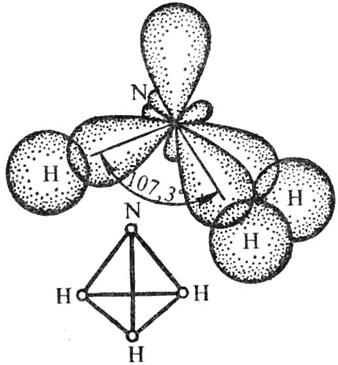
Рис. 5. Схема образования химических связей в молекуле NH3
Форма молекулы аммиака – пирамидальная.
N+7 1s2 2s2 2p3 – 3 неспаренных электрона.
ÐНОН = 107,3°. Углы между связями называются валентными.
Не нашли, что искали? Воспользуйтесь поиском: