
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электронная структура атомов. Зависимость свойств элементов строения их атомов
При выборе задания исходить из того,
что задала преподаватель на уст.лекции!!!
ВВЕДЕНИЕ
Химия является одной из важнейших естественных наук. Без знания химии немыслимо понимание процессов превращения веществ, совершенствование и создание новых, в том числе, экологически чистых процессов, машин, приборов, установок, создание веществ и материалов, которых нет в природе.
Химизация народного хозяйства приносит большой экономический эффект. Знание законов химии и их использование, выбор оптимального пути процесса исключительно важны для повышения эффективности производства и качества продукции. Знание химии позволяет решать энергетические, сырьевые и экологические проблемы, являющиеся актуальными в любом производстве, бизнесе и жизни.
В методических указаниях кратко изложены основные разделы курса общей химии, представлены решения типовых задач и контрольные задания для студентов заочного отделения.
За основу в методических указаниях взято учебное пособие Глинка Н.Л. «Задачи и упражнения по общей химии»/под ред. В.А.Рабиновича и Х.М. Рубинной – 22-е изд. стереотипное. Также использован материал из методического пособия Бережной А.И. «Программа, методические указания, решение типовых задач и контрольные задания для студентов-заочников инженерно-технических специальностей вузов».
1. 
 СТРОЕНИЕ АТОМА
СТРОЕНИЕ АТОМА
Электронная структура атомов. Зависимость свойств элементов строения их атомов
При решении вопросов, связанных с электронной структурой атомов, следует исходить из того, что любое устойчивое состояние электрона в атоме характеризуется определенными значениями квантовых чисел n, l, m и s. Состояние электрона в атоме, отвечающее определенным значениям квантовых чисел n, l и m, называется атомной электронной орбиталью.
Каждая атомная орбиталь (АО) характеризуется определенным распределением в пространстве волновой функции j, квадрат которой определяет вероятность обнаружения электрона в соответствующей области пространства. Атомные орбитали, которым отвечают значения l, равные 0, 1, 2 и 3, называются соответственно s-, p-, d- и f- орбиталями. В графических схемах электронного строения атомов каждая орбиталь обозначается символом ÿ.
Согласно принципу Паули, в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая атомная орбиталь может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что символически обозначают так: ↓↑
Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по АО, при котором энергия атома минимальна. Поэтому АО заполняются в порядке последовательного возрастания их энергий (при этом не должен нарушаться принцип Паули!). Порядок заполнения электронами АО определяется правилами Клечковского, которые учитывают зависимость энергии орбитали от значений как главного (n), так и орбитального (l) квантовых чисел. Согласно этим правилам, АО заполняются электронами в порядке последовательного увеличения суммы n+l (1-е правило Клечковского), а при одинаковых значениях этой суммы – в порядке последовательного возрастания главного квантового числа n (2-е правило Клечковского).
Размещение электронов по АО в пределах одного энергетического подуровня определяется правилом Хунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по АО данного подуровня, при котором абсолютное значение суммарного спина атома максимально; при любом другом размещении электронов атом будет находиться в возбужденном состоянии, т. е. будет характеризоваться более высокой энергией.
Электронными аналогами называются элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы.
Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением последнего в положительно заряженный ион. Энергию ионизации обычно выражают в электрон-вольтах (эВ).
Энергию ионизации можно определять, бомбардируя атомы электронами, ускоренными в электрическом поле. Наименьшую разность потенциалов, при которой скорость электрона становится достаточной для ионизации атомов, называют потенциалом ионизации атомов данного элемента. Потенциал ионизации (I), выраженный в вольтах (В), численно равен энергии ионизации (Е), выраженной в электрон-вольтах.
При затрате достаточной энергии можно удалить из атома два, три и более электрона. Первый потенциал ионизации соответствует энергии отрыва первого электрона, второй – энергии отрыва второго электрона и т. д.
По мере последовательного отрыва электронов от атома положительный заряд образующегося иона возрастает. Поэтому для удаления каждого последующего электрона требуется большая затрата энергии, так что последовательные потенциалы ионизации атома (I1, I2, I3, …) возрастают. Это видно на примере атомов бериллия, бора и углерода:
Ве В С
I1 9,3 8,3 11,3
I2 18,2 25,2 24,4
I3 253,9 37,9 47,9
Особенно резко возрастает потенциал ионизации при отрыве электрона с главным квантовым числом меньше, чем у предыдущего электрона. Так, в случае Ве (1s2 2s2) разность между I1 и I2 намного меньше, чем между I1и I3. это связано с большей затратой энергии на удаление третьего электрона, находящегося, в отличие от двух предыдущих, на более близком от ядра расстоянии.
При прочих равных условиях потенциал ионизации тем больше, чем больше заряд ядра и меньше радиус атома или иона. С этой точки зрения в периоде с ростом заряда ядра должна наблюдаться тенденция к возрастанию потенциала ионизации (при удалении электрона с одним и тем же главным квантовым числом). Действительно, значения I1 и I2 для Ве меньше, чем соответствующие значения для С.
Но, кроме того, потенциал ионизации зависит и от электронной конфигурации атома или иона. В частности, полностью или наполовину заполненные подуровни обладают повышенной устойчивостью. Из сравнения электронных конфигураций рассматриваемых атомов
Be 1S2 2S2; В 1S2 2S22р1 ; С 1S2 2S22Р2
следует, что наиболее устойчива электронная конфигурация атома Ве (полностью заполненный 2s-подуровень), поэтому на его ионизацию затрачивается повышенная энергия. У бора, несмотря на возрастание заряда ядра, отрыв 2р-электрона требует меньшей затраты энергии, чем отрыв 2s-электрона от атома бериллия.
Задачи
1. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого  ?
?  ?
?
2. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом 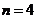 ?
?
3. Определить по правилу Клечковского последовательность заполнения электронных орбиталей, характеризующихся суммой n+l: а) 5; б) 6; в) 7.
4. Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4p.
5. Какой подуровень заполняется в атомах после подуровня 5s?
6. У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого подуровня?
7. Какой подуровень заполняется в атомах после заполнения подуровня 5p?После заполнения подуровня 5d?
8. Записать электронные формулы атомов электронов с зарядами ядра: а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
9. Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а)  ; б)
; б)  ; в)
; в)  ; г)
; г) 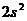 ; д)
; д) 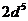 ; е)
; е)  ; ж)
; ж)  ; З.)
; З.)  ; и)
; и)  .
.
10. Сколько вакантных 3d-орбиталей имеют возбужденные атомы: а) Cl; б) V; в) Mn?
11. Сколько неспаренных электронов содержат невозбужденные атомы: а) В; б) S; в) As; г) Cr; д) Hg; е) Eu?
12. Составить электронно–графические схемы ионов  и
и  . Чем можно объяснить особую устойчивость электронной конфигурации иона
. Чем можно объяснить особую устойчивость электронной конфигурации иона  ?Указать особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
?Указать особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
13. Структура валентного электронного слоя атома элемента выражается формулой: а) 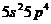 ; б)
; б)  . Определить порядковый номер и название элемента.
. Определить порядковый номер и название элемента.
14. Электронная структура атома описывается формулой  . Какой это элемент?
. Какой это элемент?
15. Написать электронные формулы ионов: а)  ; б)
; б)  ; в)
; в)  ; г)
; г)  ; д)
; д)  ;е)
;е)  .
.
16. У элементов каких периодов электроны внешнего слоя характеризуются значением n+l=5?
17. Перечислить электронные аналоги среди элементов VI группы периодической системы элементов. Написать в общем виде электронные формулы валентных электронных подуровней атомов этих элементов.
18. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?
19. Почему медь имеет меньший атомный объем, чем калий, расположенный в той же группе и в том же периоде?
20. Для атома углерода значение последовательных потенциалов ионизации составляют (в В): I1=11,3, I2=24,4, I3=47,9, I4=64, I5=392. Объяснить: а) ход изменения потенциалов ионизации; б) чем вызван резкий скачок при переходе от I4 к I5.
21. Энергии ионизации атомов благородных газов составляют (в эВ): He – 24,6; Ne – 21,6; Ar – 15,8; Kr – 14,0; Xe – 12,1; Rn – 10,8. объяснить ход измерения энергии ионизации в этой подгруппе.
22. Значения первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (в В): Li – 5,4; Cs – 3,9; Cu – 7,7; Ag – 9,2. Указать: а) у элементов какой подгруппы I группы металлические свойства выражены более резко; б) чем объяснить различный ход изменения значений потенциалов ионизации в подгруппах.
23. Одинакова ли энергия ионизации атома цезия и атома лития, у какого валентный электрон предварительно возбужден на 6s-подуровень? Ответ обосновать.
24. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? Чем объяснить, что первый потенциал ионизации атома Ве больше, чем атомов Li и B?
25. Объяснить ход изменения энергии ионизации (в эВ) в ряду Mg – Al – Si:
Mg Al Si
 7,6 6,0 8,2
7,6 6,0 8,2
 15,0 18,8 16,3
15,0 18,8 16,3
 80,1 28,4 33,5
80,1 28,4 33,5
Не нашли, что искали? Воспользуйтесь поиском: