
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тепловые машины. Цикл Карно.
Тепловым двигателем называют машины, пеобразующие внутреннюю энегргию топлива в механическую.
Для работы теплового двигателя необходимо наличие двух тел с различными температурами. Они называются нагреватель и холодильник. Кроме того, необходимо рабочее тело (пар или газ). В процессе работы рабочее тело забирает у нагревателя некоторое количество теплоты Q1 и превращает часть его в механическую энергию A путем расширения, а непревращенную часть теплоты Q2 передает холодильнику. При этом система возвращается в исходное состояние. По закону сохранения и превращения энергии A = Q1 – Q2
Второе начало термодинамики (формулировка Планка): невозможен такой периодический процесс, единственным результатом которого было бы превращение теплоты в работу.
Коэффициент полезного действия теплового двигателя

 |
Цикл Карно (цикл идеальной тепловой машины):
V. Идеальная тепловая машина. Цикл Карно.
Во всех реальных тепловых машинах происходят те или иные потери энергии.
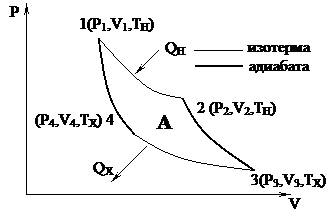
| Если в машине отсутствуют потери на теплопроводность, лучеиспускание, трение и т.д., т.е. нет необратимых потерь, то тепловая машина называется идеальной. Анализируя работу тепловых двигателей, французский инженер Сади Карно в 1824 г. нашел, что наивыгоднейшим, с точки зрения КПД, является обратимый круговой процесс, состоящий из изотермических и адиабатных процессов. Прямой круговой процесс, состоящий из двух изотермических процессов и двух адиабатических, называется циклом Карно. |
(1) – контакт рабочего тела с нагревателем
(1-2) – изотермическое расширение, от нагревателя отбирается тепло Q
(2) – прекращение контакта рабочего тела с нагревателем
(2-3) – адиабатическое расширение. U уменьшается и температура понижается TX < TH
(3) – контакт с холодильником (ТХ)
(3-4) – изотермическое сжатие. Тепло отбирается холодильником от рабочего тела
(4) – прекращение контакта с холодильником
(4-1) – адиабатическое сжатие, U увеличивается и температура повышается до Тисх
Цикл Карно обратим так как все его составные части являются равновесными процессами. КПД цикла Карно:

Примеры реальных циклов:
1. Цикл Отто (сгорание при V = const)
 |
1-2 – адиабатическое сжатие
2-3 – изохорное нагревание
3-4 – адиабатическое расширение
4-1– изохорное охлаждение
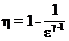 ,
,
где γ – показатель адиабаты;
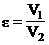 – степень сжатия;
– степень сжатия;
2. Цикл Дизеля (сгорание при Р = const)

1-2 – адиабатическое сжатие
2-3 – изобарное нагревание
3-4 – адиабатическое расширение
4-1 – изохорное охлаждение
 ,
,
где  – степень сжатия;
– степень сжатия;
 – степень предварительного расширения;
– степень предварительного расширения;
γ – показатель адиабаты.
III. Теорема Клаузиуса. Энтропия.
Формулу η идеальной тепловой машины, работающей по циклу Карно:

легко привести к виду
 (1)
(1)
Отношение количества переданного (полученного) тепла системой к температуре нагревателя (этого процесса) или холодильника (теплоприемника) называется приведенной теплотой.
Смысл уравнения (1): приведенные теплоты при процессах изотермического расширения и сжатия одинаковы.
Перепишем уравнение (1) в виде:

Будем считать, что отдаваемая системой теплота отрицательная, Qx < 0, тогда можем записать:
 (2)
(2)
Алгебраическая сумма приведенных теплот для обратимого цикла Карно равна нулю.
Если рассмотреть любой равновесный цикл, то легко показать, что его можно представить как совокупность циклов Карно, т.е.:

Теорема Клаузиуса (1854 г.): сумма приведенных теплот не зависит от пути перехода.
Согласно уравнения (2) для каждого элементарного процесса
 , а
, а
в пределе для любого обратимого цикла:
 (3)
(3)
В случае необратимой тепловой машины (реальные тепловые машины), как показано в разделе II:
 , или
, или  (4)
(4)
Можно показать 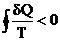 . Объединяя (3) и (4) имеем:
. Объединяя (3) и (4) имеем:
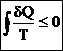 – равенство (неравенство) Клаузиуса (5)
– равенство (неравенство) Клаузиуса (5)
справедливо для любого кругового процесса.
 |
энтропия.

Как и внутренняя энергия, энтропия есть функция параметров системы P, V, и Т:
S = S(P,V,T)
S имеет размерность теплоемкости.
| Энтропия есть такая функция состояния системы, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением. |
dQ = TdS.
Согласно определения энтропии, имеем для обратимого процесса:
 , (7)
, (7)
т.е. приращение энтропии равно элементарному количеству тепла, полученному системой, к температуре, при которой тепло получается.
Для обратимого кругового процесса ∆S = 0.
Легко показать, что для необратимого процесса

Для необратимого кругового процесса ∆S > 0.
Для произвольного процесса имеем:
∆S ≥ 0 (8)
| Энтропия изолированной системы при любых происходящих в ней процессах не может убывать (или постоянна, или возрастает). |
Энтропия – греческое слово «энтропос» – поворот, возвращение.
Следствие:
а) энтропия изолированной системы при обратимых процессах не изменяется
(∆S = 0)
б) энтропия изолированной системы при необратимых процессах возрастает
(∆S > 0)
в) все реальные процессы необратимы, энтропия их возрастает.
Возрастание энтропии определяет направление процесса (в сторону возрастания).
Второй закон термодинамики (ещё одна формулировка).
| В изолированной системе при всех реальных процессах энтропия возрастает. |
Естественные процессы направлены к состоянию равновесия. А т.к. при этом энтропия увеличивается, то устойчивому равновесию изолированной системы соответствует максимальное значение энтропии.
Согласно уравнения (8), если система не изолирована (обмен теплом с внешней средой), то энтропия может вести себя любым образом (возрастать при получении тепла и убывать при отдаче).
V. Энтропия и вероятность. Философское значение второго закона термодинамики.
Процессы, изучаемые термодинамикой, рассматриваются и статистической физикой. Это рассмотрение приводит к другим результатам, чем те, к которым приходит термодинамика.
| Процессы, невозможные по второму закону (переход тепла от холодного тела к нагретому), в статистической физике являются не невозможными, а очень мало вероятными. |
Связь S с вероятностью w установлена Больцманом

| Энтропия пропорциональна логарифму вероятности состояния или: Все процессы в природе протекают в направлении, приводящем к увеличению вероятности состояния. |
Формулировка Клаузиуса второго закона термодинамики:
| энтропия мира стремится к максимуму. |
Однако, как показано ранее, законы термодинамики нельзя применять к микромиру, так нельзя их обобщать и для явлений вселенной.
Такое обобщение привело к представлению о так называемой «тепловой смерти» вселенной.
Суть «тепловой смерти»:
во всех частях Вселенной любые процессы сопровождаются тем, что некоторое количество энергии различных видов превращается в теплоту, а теплота переходит от нагретых тел к холодным, т.е. происходит выравнивание температур, а следовательно развитие природы ведет к прекращению развития: все виды энергии превращаются в теплоту и в ней находят свою смерть.
Не нашли, что искали? Воспользуйтесь поиском: