
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Исследование уравнения Ван-Дер-Ваальса
Преобразуем формулу (3.1), раскрыв скобки и умножив обе части равенства на V2/p:
 ,
,
далее расположим слагаемые в порядке убывающих степеней V:
 . (3.3)
. (3.3)
Полученное выражение является кубическим уравнением относительно объема[5].
Зададимся некоторой определенной температурой T и для нее построим график, выражающий связь V и p по формуле (3.3). Будем давать p, например 1 атм, 1, 5, 2, 2,5 атм и.т.д. Подставляя вместо p его значения, будем получать кубическое уравнения с численными коэффициентами (a, b, R - табличные данные, T - заданная температура). Если для V получится один вещественный корень, соответствующий данному p, на графике будет точка с координатами (p,V). Если при решении уравнения окажутся три вещественных корня, данному давлению будут соответствовать три возможных объема (V1, V2, V3) и кривая, изображающая графически уравнение (3.3), очевидно, будет иметь перегибы. В результате изотерма Ван-Дер-Ваальса примет вид, изображенный на рис. (3.4). Ее участок 1-2 соответствует такому же участку, полученному экспериментальным путем на изотерме Эндрюса. Это состояние ненасыщающего пара. Участок 2-3 на опыте получается в виде прямой, на изотерме же Ван-дер-Ваальса - кривая 2-2'-3'-3. Несовпадение этого участка графика с опытными данными не является неожиданным, так как он соответствует состоянию насыщающего пара, для которого формула Клайперона - Менделеева неприменима (уравнение Ван-дер-Ваальса есть подправленная форма уравнения состояния идеального газа). Однако участки 2-2' и 3-3' при известных условиях могут быть получены на опыте и только участок 2'-3' экспериментально неосуществим. Если осторожно сжимать сначала ненасыщенный пар, а затем после достижения его насыщения (точка 2) продолжать сжатие, при отсутствии в нем ионов и пылинок, которые являются центрами конденсации, можно получить участок 2-2', соответствующий пресыщающему пару. Его давление не может превысить p1; достигнув его, пресыщающий пар начинает бурно конденсироваться, давление падает до pн и
 p 4
p 4
2΄
 2
2
 3
3
3΄
p2 p1 pн


 1
1
0 V
 Рис. 3.4. Изотерма Ван-Дер-Ваальса
Рис. 3.4. Изотерма Ван-Дер-Ваальса
дальше (до точки 3) не изменяется. Если постепенно уменьшать давление на сжатую жидкость и продолжать осторожно приподнимать поршень в цилиндре, достигнув при этом давления, соответствующего точке 3', то можно несколько перегреть или <<растянуть>> жидкость и получить экспериментально участок изотермы 3'-3. При достижении газом точки 3' поршень отрывается от жидкости, давление от значения p2 возрастает до значения pн вследствие интенсивного парообразования. Участок 3-4 характеризует жидкую фазу.
На рис. (3.5) показан ряд изотерм Ван-дер-Ваальса, построенных для различных температур. Изотерма Tк соответствует критической температуре. Изотермы, расположенные выше нее (для более высоких температур), характеризуются тем, что вещество при этих температурах остается в газообразном состоянии и ни при каком давлении не может быть обращено в жидкость. Для точки K можно найти значение Vк, подставив в уравнение (3.3) значения критического давления pк и критической температуры T. В этом случае формула принимает вид:
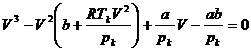 . (3.4)
. (3.4)
С другой стороны, любое кубическое уравнение, имеющие корни V1, V2, V3, можно записать в виде:
(V-V1)(V-V2)(V-V3)=0. (3.5)
Но для точки K все три корня сливаются в один, т.е. V1=V2=V3=Vк и последнее соотношение принимает вид:
(V-Vk)3=0.




 р
р

 рк К
рк К
 | |||
 |
0 Vk V
Рис. 3.5. Изотермы Ван-Дер-Ваальса, соответствующие температурам, близким к критической
Раскрывая скобки, его можно привести к виду:
V3-3VkV2+3VkV-Vk3=0. (3.6)
Так как уравнения (3.4) и (3.6) являются тождественными, их коэффициенты при одинаковых степенях неизвестных должны быть равны. Поэтому можно записать:
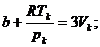
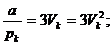
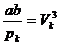 . (3.7)
. (3.7)
Эти уравнения связывают между собой шесть величин. Зная три из них, остальные три можно найти. Например, можно теоретически подсчитать критические параметры Vк, pк, Tк по известным a, b, R. И, наоборот, зная Vк, pк, Tк, можно найти постоянные Ван-дер-Ваальса a и b:
 ,
, 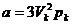 . (3.8)
. (3.8)
Характерно, что критический объем оказывается равным утроенной постоянной b. Однако эти соотношения являются приближенными. В некоторых таблицах критических параметров значение критического объема не приводится. Поэтому приведем выражение параметров Ван-Дер-Ваальса a и b через pк, Tк:
 ,
, 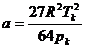 . (3.9)
. (3.9)
Т а б л и ц а 3.3
Удельная теплота парообразования воды при разных температурах
| t, ˚C | ||||
| r, М Дж/кг | 2,49 | 2,38 | 2,26 | 1,94 |
Предлагаем вам получить эти выражения из (3.7) самостоятельно.
Не нашли, что искали? Воспользуйтесь поиском: