
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Смеси жидкостей, паров и газов
Общие соотношения
Термодинамическая система – объект исследования термодинамики, может представлять собой смесь химически не взаимодействующих между собой чистых веществ. Предполагается также, что структура отдельных компонентов смеси в процессе смесеобразования и стабилизации смеси не изменяется.
Из закона сохранения материи следует, что масса смеси G равна сумме масс составляющих ее компонентов Gi
 ,(196)
,(196)
а число киломолей смеси  равно сумме числа киломолей всех компонентов смеси
равно сумме числа киломолей всех компонентов смеси 
 , (197)
, (197)
где  – число компонентов в смеси.
– число компонентов в смеси.
Одной из важнейших характеристик смеси является ее состав. Он задается массовыми или молярными концентрациями (долями) компонентов.
Массовой концентрацией или массовой долей mi называется отношение массы компонента к массе всей смеси
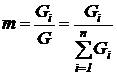 . (198)
. (198)
Молярной концентрацией или молярной долей i -го компонента  называется отношение количества киломолей этого компонента
называется отношение количества киломолей этого компонента  к общему числу киломолей смеси
к общему числу киломолей смеси
 . (199)
. (199)
Очевидно, что для термодинамических смесей справедливы следующие соотношения:
 ,
,  . (200)
. (200)
Средняя (кажущаяся) молярная масса смеси  равна отношению массы смеси к количеству киломолей смеси и может быть определена из следующих соотношений:
равна отношению массы смеси к количеству киломолей смеси и может быть определена из следующих соотношений:
 =
=  =
= 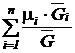 =
=  ; (201)
; (201)
 =
=  =
=  =
=  =
=  . (202)
. (202)
Зависимость между массовой и молярной концентрациями устанавливается соотношением
 =
=  =
=  (203)
(203)
или
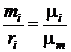 . (204)
. (204)
Газовая постоянная смеси  может быть вычислена по следующему выражению:
может быть вычислена по следующему выражению:
 =
=  =
=  , (205)
, (205)
где  =8314 Дж/(кмоль К) – универсальная газовая постоянная, Ri – характеристическая газовая постоянная компонента смеси.
=8314 Дж/(кмоль К) – универсальная газовая постоянная, Ri – характеристическая газовая постоянная компонента смеси.
Для жидких, твердых и газообразных смесей часто используется и понятие объемной концентрации компонентов. Объемной концентрацией i -го компонента  называется отношение объема данного компонента Vi к объему всей смеси V
называется отношение объема данного компонента Vi к объему всей смеси V
 . (206)
. (206)
Схемы смешения
При образовании смесей на практике встречаются две основные схемы смешения: при постоянном объеме (V = idem, рис. 18 а) и постоянном давлении (p = idem, рис. 18 б).

Рис. 18. Схемы смешения при постоянном объеме (а)
и при постоянном давлении (б)
При расчете и анализе схемы смешения при постоянном объеме рассматривается система, включающая ряд резервуаров, соединенных трубопроводами с установленными на них кранами (рис. 18 а). В каждом резервуаре
объемом Vi находится один компонент с известными исходными
параметрами (Gi,  ,
,  , Ti). После открытия кранов во всех резервуарах происходит выравнивание давления pm, а затем температуры Tm и концентрации компонентов (mi, ri) – система переходит в состояние термодинамического равновесия. Во всех стадиях процесса смешения полный объем системы сохраняет неизменную величину V =
, Ti). После открытия кранов во всех резервуарах происходит выравнивание давления pm, а затем температуры Tm и концентрации компонентов (mi, ri) – система переходит в состояние термодинамического равновесия. Во всех стадиях процесса смешения полный объем системы сохраняет неизменную величину V =  .
.
В процессе смешения по схеме с постоянным объемом теплота извне не подводится ( ) и внешняя работа не совершается (
) и внешняя работа не совершается ( ) и, следовательно, исходя из первого начала термодинамики по внешнему балансу (35), получаем, что этот процесс смешения идет без изменения внутренней энергии
) и, следовательно, исходя из первого начала термодинамики по внешнему балансу (35), получаем, что этот процесс смешения идет без изменения внутренней энергии
 (
( ). (207)
). (207)
Смесеобразование при постоянном давлении происходит в трубопроводах (рис. 18 б). К общему трубопроводу отдельными потоками подводятся компоненты. Для каждого компонента известны: массовый расход Gi, молярная масса m i, давление pi и температура Ti. Смесеобразование в трубопроводе возможно лишь в случае, когда давление каждого компонента pi больше среднего давления смеси в трубопроводе  . При прохождении запорного устройства давление компонента уменьшается до среднего давления смеси
. При прохождении запорного устройства давление компонента уменьшается до среднего давления смеси  – отсюда наименование схемы (
– отсюда наименование схемы ( ).
).
Заключительные стадии процесса смешения при  – выравнивание температур, концентраций компонентов в смеси (диффузионные процессы) и переход системы в состояние термодинамического равновесия.
– выравнивание температур, концентраций компонентов в смеси (диффузионные процессы) и переход системы в состояние термодинамического равновесия.
В процессе смешения при  теплота извне не подводится (
теплота извне не подводится ( ) и внешняя работа не совершается (
) и внешняя работа не совершается (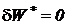 ) и, следовательно, исходя из первого начала термодинамики по внешнему балансу для потока (81), получаем, что этот процесс смешения идет без изменения энтальпии
) и, следовательно, исходя из первого начала термодинамики по внешнему балансу для потока (81), получаем, что этот процесс смешения идет без изменения энтальпии
 (
(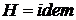 ). (208)
). (208)
Не нашли, что искали? Воспользуйтесь поиском: