
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Амфотерные гидроксиды. 1. В нейтральной среде (чистая вода) амфотерные гидроксиды практически не растворяются и не диссоциируют на ионы
1. В нейтральной среде (чистая вода) амфотерные гидроксиды практически не растворяются и не диссоциируют на ионы. Они растворяются в кислотах и щелочах. Диссоциацию амфотерных гидроксидов в кислой и щелочной средах можно выразить следующими уравнениями:
Zn  + OH-
+ OH-  Zn(OH)
Zn(OH) 
 H+ + ZnO
H+ + ZnO 
А13+ + ЗОН-  Al(OH)3
Al(OH)3  H+ + AlO
H+ + AlO 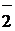 + H2O
+ H2O
2. Амфотерные гидроксиды взаимодействуют как с кислотами, так и со щелочами, образуя соль и воду.
Взаимодействие амфотерных гидроксидов с кислотам:
Zn(OH)2 + 2НCl + ZnCl2 + 2Н2О; Sn(OH)2+ H2SO4 = SnSO4 + 2Н2О.
Взаимодействие амфотерных гидроксидов со щелочами:
Zn(OH)2 + 2NaOH  Na2ZnO2 + 2H2O;
Na2ZnO2 + 2H2O;
А1(ОН)3 + NaOH  NаАlO2 + 2Н2О;
NаАlO2 + 2Н2О;
Zn(OH)2 + 2NaOH  Na2[Zn(OH)4];
Na2[Zn(OH)4];
Pb(OH)2 + 2NaOH  Na2[Pb(OH)4].
Na2[Pb(OH)4].
Соли – продукты замещения атомов водорода в молекуле кислоты на атомы металла или замещения гидроксид-иона в молекуле основания кислотными остатками.
Общие химические свойства солей
1. Соли в водных растворах диссоциируют на ионы:
а) средние соли диссоциируют на катионы металлов и анионы кислотных остатков:
NaCN =Na++СN-;
Ва(СН3СОО)2 = Ва2+ + 2(СН3СОО)-.
6) кислые соли диссоциируют на катионы металла и сложные
анионы:
KHSО3 = К+ + HSO32-;
NaH2PO4 = Na+ + Н2РО4-.
в) основные соли диссоциируют на сложные катионы и анионы кислотных остатков:
АlОН(СН3СОО)2 = АlОН2+ + 2СН3СОО-.
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Данный металл может вытеснять из растворов солей только те металлы, которые находятся правее его в электрохимическом ряду напряжения:
CuSO4 + Fe = FeSO4 + Сu.
3. Растворимые соли взаимодействуют со щелочами с образованием новой соли и нового основания. Реакция возможна, если образующееся основание или соль выпадают в осадок. Например:
FeCl3+3КОН=Fe(OH)3↓+3КС1;
К2СО3+Ba(OH)2=ВаCO3↓+ 2КОН.
4. Соли взаимодействуют с кислотами с образованием новой более слабой кислоты или новой нерастворимой соли:
Na2CO3 + 2HC1 = 2NaCl + CO2↑ + H2O.
При взаимодействии соли с кислотой, образующей данную соль, получается кислая соль (это возможно в том случае, если соль образована многоосновной кислотой). Например:
Na2S + H2S = 2NaHS; CaCO3 + CO2+ H2O = Ca(HCО3)2 .
5. Соли могут взаимодействовать между собой с образованием новых солей, если одна из солей выпадает в осадок:
AgNO3 + KC1 = AgCl↓ + KNO3.
6. Многие соли разлагаются при нагревании:
MgCО3 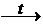 MgO + CО2↑;
MgO + CО2↑;
2NaNO3 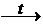 2NaNO2 + O2↑.
2NaNO2 + O2↑.
7. Основные соли взаимодействуют с кислотами с образованием средних солей и воды:
Fe(OH)2NO3+HNO3=FeOH(NO3)2+H2O; FeOH(NO3)2+HNO3=Fe(NO3)3 + H2O.
8. Кислые соли взаимодействуют с щелочами с образованием средних солей и воды:
NaHSO4 + NaOH = Na2SO3 + H2O;
КН2РО4 + КОН = К2НРО4 + Н2О.
Получение солей
Все способы получения солей основаны на химических свойствах важнейших классов неорганических соединений. Десять классических способов получения солей представлены в табл. 8. Кроме общих способов получения солей, возможны и некоторые частные способы:
1. Взаимодействие металлов, оксиды и гидроксиды которых являются амфотерными, с щелочами.
2. Сплавление солей с некоторыми кислотными оксидами.
K2CO3 + SiO2  K2SiO3 + CO2↑.
K2SiO3 + CO2↑.
3. Взаимодействие щелочей с галогенами:
2КОН +Сl2  KCl +KClO + H2O;
KCl +KClO + H2O;
4. Взаимодействие галогенидов с галогенами:
2КВг + Cl2 = 2КС1 +Вг2
Таблица 8 ‑ Основные способы получения солей
Не нашли, что искали? Воспользуйтесь поиском: