
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Предмет и понятие электрохимии. Теория диссоциации, ее недостатки
Электрохимия – раздел физической химии, в котором изучаются законы взаимодействия и взаимосвязи химических и электрохимических явлений.
Основной предмет изучения электрохимии – это процессы, протекающие на электродах при прохождении электрического тока через раствор (так называемые электродные или электрохимические процессы).
В 1883 г. Аррениус предложил теорию электролитической диссоциации, которая в последствие получила название теории слабых электролитов.
Согласно этой теории, процесс распада веществ в растворе на ионы называют электролитической диссоциацией.
Основные положения теории Аррениуса:
1. Кислота – это вещества, диссоциирующие на ион H+ и анион.
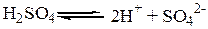
Основания распадаются при диссоциации на гидроксил-ион 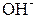 и катион.
и катион.
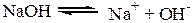
Соли диссоциируют на катион и анион.
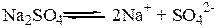
2. Соли являются сильными электролитами и полностью диссоциируют на ионы. Кислоты и основания могут быть сильными и слабыми электролитами (следовательно, диссоциируют как полностью, так и частично).
3. Процесс диссоциации электролитов на ионы является равновесным. Равновесие устанавливается между ионами и непродиссоциированными молекулами.
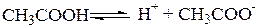
Теория Аррениуса имеет ряд недостатков:
1. не учитывает взаимодействие между ионами в растворе. Согласно теории Аррениуса, ионы в растворе распределены хаотично. Если это так, то раствор электролита идеальный. В реальности, это применимо только к слабым электролитам, поэтому данную теорию называют теорией слабых электролитов;
2. не учитывает взаимодействие ионов с растворителем;
3. не учитывает природу растворителя;
4. не объясняет причину диссоциации электролитов в растворе на ионы.
В действительности распад вещества на ионы в растворе осуществляется за счет того, что при диссоциации энергия (Е) взаимодействия между ионами в кристалле (Еион-ион – энергия ион-ионного взаимодействия) становится меньше Е взаимодействия иона с диполем растворителя (Е ион-дип – энергия ион-дипольного взаимодействия). Ионы «вырываются» молекулами растворителями из кристаллической решетки вещества, и происходит процесс диссоциации (распада) вещества на ионы. Условие диссоциации вещества на ионы в растворе: Е ион-ион. < Е ион-дип.
Не нашли, что искали? Воспользуйтесь поиском: