
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема 10. Химическая идентификация и анализ веществ
181. На титрование 20,00 мл раствора NaCl требуется 18,25 мл 0,1140 н. AgNO3. Найти нормальность раствора NaCl.
182. В трёх пробирках находятся растворы хлорида натрия, хлорида алюминия и хлорида меди (II). Как определить содержимое каждой из пробирок? Составьте соответствующие молекулярные и ионные уравнения реакций. Укажите признаки реакций.
183. Рассчитайте процентное содержание железа в руде, если из навески руды 0,7020 г получено 0,4344 г Fe2O3?
184. Рассчитать объем, в котором надо растворить навеску бромата калия массой 0,4566 г, чтобы получить раствор с молярной концентрацией эквивалента 0,0500 моль/л.
185. В четырёх пробирках даны растворы: а) соляной кислоты; б) хлорида натрия; в) гидроксида натрия; г) нитрата серебра(I). Определите эти вещества при помощи характерных реакций. Составьте соответствующие молекулярные и ионные уравнения.
186. Определите, в какой из пронумерованных пробирок находится каждое из перечисленных веществ: хлорид алюминия, сульфат калия, хлорид меди (II). Составьте соответствующие молекулярные и ионные уравнения реакций. Укажите признаки реакций.
187. При гравиметрическом определении фосфора в анализируемом образце фосфата массой 2г получили массу гравиметрической формы Mg2P2O7, равную 0,4895г. Рассчитайте содержание фосфора в образце.
188. Навеску 4,856 г KCNS растворили в мерной колбе ёмкостью 500 мл. На титрование 25,00 мл раствора израсходовано 24,95 мл раствора Hg(NO3)2. Определить молярную концентрацию эквивалентов раствора Hg(NO3)2.
189. Как доказать присутствие иодида бария в растворе хлорида алюминия?
190. Исследуемое вещество может быть КОН или NaOH. Для нейтрализации 1,10 г этого вещества потребовалось 31,4 мл 0,860 н. раствора HCl. Что это за вещество?
191. Установите формулу соединения, если получены следующие результаты элементного анализа: Fe - 44,09%; S - 55,91%.
192. На титрование раствора H2SO4 израсходовано 25,40 мл 0,2140 н. NaOH. Сколько граммов H2SO4 в растворе?
193. Определите, в какой из пронумерованных пробирок находится каждое из перечисленных веществ: карбонат натрия, сульфат аммония, хлорид калия. Составьте соответствующие молекулярные и ионные уравнения реакций. Укажите признаки реакций.
194. Сколько граммов KCl содержится в 250 мл раствора, если на титрование 25,0 мл его израсходовали 34,00 мл 0,01000 н. раствора AgNO3.
195. Сколько надо взять 8,4%-го раствора H2SO4 для осаждения бария из 0,4859 г хлорида бария?
196. Установите формулу кристаллогидрата, если получены следующие результаты элементного анализа: Na2SO4 - 63,64%; H2O - 36,36%.
197. Вычислите молярную концентрацию раствора HCl, если на титрование 0,0976г Na2B4O7 было затрачено 21,55 мл этого раствора.
198. Как одним реагентом различить водные растворы НВr, NаF, КОН, АlCl3? Написать уравнения соответствующих реакций.
199. В трех пробирках находятся растворы бромидов магния, алюминия и аммония. С помощью одного реагента определите, какое вещество находится в каждой пробирке.
200. При анализе карбоната магния было определено 17,39% магния и 39,13% кристаллизационной воды. Какова формула кристаллогидрата?
ВОПРОСЫ К ЭКЗАМЕНУ
1. Предмет химии. Основные понятия химии: атом, химический элемент, молекула, ион. Простые и сложные вещества. Химические формулы и химические уравнения.
2. Атомная единица массы. Относительная атомная и молекулярная массы.
3. Количество вещества. Моль. Молярная масса и молярный объем.
4. Эквивалент. Молярная масса эквивалента и ее расчет. Эквивалентный объем. Закон эквивалентов.
5. Основные стехиометрические законы химии: закон сохранения массы, закон постоянства состава, закон Авогадро и следствия из него.
6. Газовые законы: закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, универсальный газовый закон. Уравнение Менделеева-Клапейрона.
7. Оксиды. Номенклатура. Классификация. Химические свойства. Получение.
8. Основания. Номенклатура. Классификация. Химические свойства. Получение.
9. Кислоты. Номенклатура. Классификация. Химические свойства. Получение.
10. Соли. Номенклатура. Классификация. Химические свойства. Получение.
11. Общие представления о металлах. Химические свойства и получение металлов.
12. Общие представления о неметаллах. Химические свойства и получение неметаллов.
13. Строение атома. Изотопы.
14. Квантовые числа: главное квантовое число, побочное квантовое число, магнитное квантовое число, спиновое квантовое число.
15. Закономерности застройки энергетических уровней атома. Электронные и электронно-графические формулы распределения электронов в атоме.
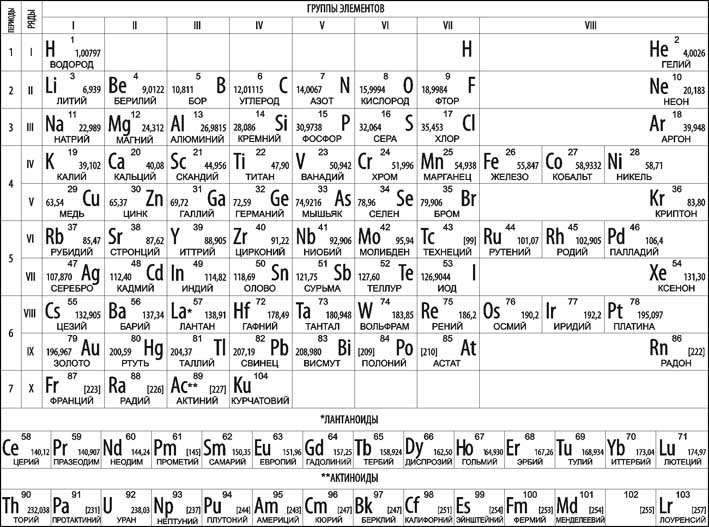
16. Периодический закон и периодическая таблица элементов Д.И. Менделеева.
17. Понятие о химической связи и механизмы ее образования.
18. Основные виды химической связи и ее характеристики: энергия, длина, кратность, полярность.
19. Ковалентная неполярная и ковалентная полярная связь. Важнейшие особенности ковалентной связи.
20. Типы перекрывания электронных орбиталей: σ- и π-связи. Гибридизация орбиталей. Типы гибридизации.
21. Ионная связь и ее характеристики.
22. Ван-дер-Ваальсовы силы. Водородная связь.
23. Металлическая связь и ее характеристики.
24. Комплексные соединения. Строение комплексных соединений.
25. Классификация комплексных соединений по заряду комплексной частицы. Номенклатура комплексных соединений.
26. Основные понятия химической термодинамики. Классификация систем по числу фаз. Изолированные, закрытые и открытые системы.
27. Первое начало термодинамики. Энтальпия. Экзо- и эндотермические реакции. Закон Гесса.
28. Химическая термодинамика. Второе и третье начало термодинамики. Энтропия.
29. Химическая термодинамика. Свободная энергия Гиббса. Уравнение Гиббса. Направление и предел самопроизвольного протекания химических реакций.
30. Химическая кинетика. Понятие о скорости химических реакций.
31. Химическая кинетика. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Правило Вант-Гоффа.
32. Химическая кинетика. Катализ. Каталитические системы.
33. Необратимые и обратимые реакции. Химическое равновесие. Константа равновесия.
34. Химическое равновесие и правила его смещения. Принцип Ле Шателье.
35. Дисперсные системы. Классификация дисперсных систем по размеру частиц дисперсной фазы.
36. Дисперсные системы. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды.
37. Грубодисперсные системы. Эмульсии и суспензии.
38. Коллоидные системы и способы их получения.
39. Коллоидные системы. Строение мицеллы.
40. Седиментационная устойчивость коллоидных систем. Правило Шульце-Гарди. Свойства коллоидных систем.
41. Общие представления о растворах. Теория растворов Д.И. Менделеева.
42. Способы выражения содержания растворенного вещества: массовая доля, мольная доля, молярность, моляльность, нормальность.
43. Электролиты и неэлектролиты. Электролитическая диссоциация.
44. Константа электролитической диссоциации. Закон разбавления Оствальда.
45. Электролитическая диссоциация кислот, оснований, солей.
46. Реакции ионного обмена и условия их протекания.
47. Произведение растворимости.
48. Ионное произведение воды. рН и рОН. Расчеты рН и рОН сильных и слабых электролитов. Индикаторы.
49. Гидролиз солей.
50. Коллигативные свойства растворов. Законы Рауля. Криоскопия. Эбуллиоскопия.
51. Коллигативные свойства растворов. Диффузия. Осмос. Закон Вант-Гоффа.
52. Характеристика и типы окислительно-восстановительных реакций.
53. Методы составления уравнений окислительно-восстановительных реакций. Метод электронного баланса. Метод ионно-электронного баланса.
54. Важнейшие окислители и восстановители. Окислительные свойства серной и азотной кислот.
55. Электрохимические системы. Гальванический элемент. Электрохимический ряд напряжений металлов.
56. Электрохимические системы. ЭДС гальванического элемента. Уравнение Нернста.
57. Электрохимические системы. Электролиз. Законы Фарадея.
58. Электрохимические системы. Особенности электролиза расплавов и растворов солей.
59. Аккумуляторы. Свинцово-кислотный аккумулятор и принцип его работы.
60. Определение и классификация коррозийных процессов.
61. Химическая коррозия.
62. Электрохимическая коррозия.
63. Защита металлов от коррозии.
64. Идентификация веществ и виды анализа. Качественный, количественный и структурный анализ.
65. Методы идентификации веществ. Химические, физико-химические и физические методы анализа.
66. Качественный анализ. Качественные реакции на неорганические катионы и анионы. Идентификация органических соединений.
67. Количественный анализ. Гравиметрия. Титриметрия.
68. Органические соединения. Теория органических соединений А.М. Бутлерова.
69. Классификация органических соединений по характеру С-С связи или наличию функциональной группы.
70. Важнейшие биоорганические соединения: белки, липиды, углеводы, нуклеиновые кислоты.
71. Понятие о полимерах и их классификация по типу составных звеньев и происхождению. Природные, искусственные и синтетические полимеры.
72. Методы получения полимеров. Полимеризация. Поликонденсация.
73. Строение и свойства полимеров. Вулканизация.
74. Применение полимеров и полимерных материалов. Пластмассы. Композиционные материалы.
ПРИЛОЖЕНИЕ
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
Не нашли, что искали? Воспользуйтесь поиском: