
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Вычисление через титр титранта по определяемому компоненту
Данный способ расчёта очень удобен при массовых анализах, т.к. вычислив однажды титр рабочего раствора по определяемому веществу, можно затем находить количество этого вещества простым умножением титра на затраченный объём раствора титранта.
 Титр титранта по определяемому компоненту - это число граммов
Титр титранта по определяемому компоненту - это число граммов
определяемого компонента, взаимодействующее с 1 мл титранта:
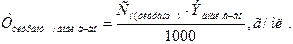 (10.2)
(10.2)
В качестве определяемого компонента может быть как вещество, так и ион или отдельный атом химического элемента.
Пример 10. Вычислить процентное содержание железа в образце FeSO4·7H20, если на титрование 10 мл раствора, приготовленного растворением 5,6731 г этой соли в мерной колбе на 250 мл, затрачено 17,8 мл 0,0456 н. раствора перманганата калия.
 Дано: Решение:
Дано: Решение:
 m(FeSO4·7H2О) = 5,6731 г 1. Данная задача посвящена обработке результатов
m(FeSO4·7H2О) = 5,6731 г 1. Данная задача посвящена обработке результатов
Vобщ (FeSO4) = 250 мл окислительно-восстановительного титрования. Для
Vа.р. (FeSO4) = 10 мл вычисления эквивалентных масс восстановителя и
Сн(KMnO4) = 0, 0456 н. окислителя, согласно формуле (1.6.) необходимо
Vт(KMnO4) = 17,88 мл знать число электронов, принятых или отданных
_________________ одной молекулой (или атомом). Поэтому нужно
ω(Fe) =? составить и решить уравнение ОВР:
+2 +7 +3 +2
10FeSO4 + 2KMnO4 + 8H2O = 5Fe2(SO4)2 + K2SO4 + 2MnSO4 + 8H20
+7 +2
 Mn + 5
Mn + 5  = Mn 5
= Mn 5
+2 +3
2Fe - 2  = 2Fe 2
= 2Fe 2
2. Для расчёта величины Ттитранта/анал.в-во по формуле (10.2.) надо вычис-
лить ЭFe, учитывая, что один ион Fe2+ отдает один электрон:
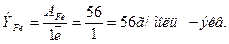
3. Находим ТKMnO4/Fe так же с точностью до четвертой значащей цифры
после последнего нуля:
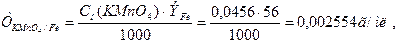
т.е. 1 мл раствора KMnO4 реагирует 0,002554 г Fe2+.
4. Рассчитаем объём титранта, необходимый для реакции с 250 мл приго-
товленного анализируемого раствора FeSO4:
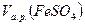 = 10 мл реагирует с
= 10 мл реагирует с 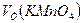 = 17,88 мл
= 17,88 мл
 = 250 мл реагирует с
= 250 мл реагирует с 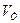 (KMnO4 на весь объём а.р.) =?
(KMnO4 на весь объём а.р.) =?

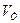 (KMnO4 на весь объём а.р.) =
(KMnO4 на весь объём а.р.) = 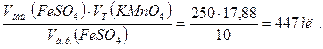
5. Находим массу Fe2+ в 250 мл анализируемого раствора:
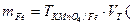 KMnO4 на весь объём а.р.) = 0,002554·445 = 1,1416 г.
KMnO4 на весь объём а.р.) = 0,002554·445 = 1,1416 г.
6. Находим процентное содержание Fe2+ в FeSO4·7H2О:
m(FeSO4·7H2О) = 5,6731 г - 100%
mFe = 1,1416 г - ω(Fe) =?

Ответ: ω(Fe) = 20,12%.
Не нашли, что искали? Воспользуйтесь поиском: