
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Всеобщий закон биологии» Бауэра
Наряду с теоретическими работами физиков над проблемами законов термодинамики, этой же проблемой, но применительно к биологии, в начале 20-го века занимался биолог-теоретик Эрвин Симонович Бауэр.
В то время биология как наука еще не была достаточно развита. Еще не был известен состав клеток и их основные функции, и было общепринятым считать, что жизнь - это некоторое вещество с особыми свойствами.
В микроскоп живое вещество различных живых организмов выглядело практически одинаково в виде клеток с желеобразной массой (которая получила название протоплазма).
Основной задачей, которую поставил перед собой Э. Бауэр - определить основные термодинамические свойства живых веществ, за которое он принимал молекулы белков в особом, неравновесном состоянии.
Несмотря на целый ряд ошибочных предположений, принципиальным научным достижением Э. Бауэра в этой работе является неопровержимое доказательство того, что живые организмы могут находиться только в устойчивом неравновесном термодинамическом состоянии. Э. Бауэром был сформулирован «Всеобщий закон биологии» в следующей редакции:
| «Все и только живые системы никогда не бывают в равновесии и исполняют за счет своей свободной энергии постоянную работу против равновесия, требуемого законами физики и химии при существующих внешних условиях». |
По существу этот закон является Первым законом термодинамики биологических систем.
Э. Бауэром также был сформулирован «Принцип устойчивого неравновесия живых систем»:
| «Для живых систем характерно именно то, что они за счет своей свободной энергии производят работу против ожидаемого равновесия». |
Позже теория Э. Бауэра была полностью подтверждена работами И. Пригожина, Г. Хакена и Р. Тома. Как утверждает И. Пригожин: «…и биосфера в целом, и ее различные компоненты, живые или неживые, существуют в сильно неравновесных условиях. В этом смысле жизнь, заведомо укладывающаяся в рамки естественного порядка, предстает перед нами как высшее проявление происходящих в природе процессов самоорганизации».
Лекция 3.
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
Химическая кинетика занимается исследованием механизмов реакций и течения их во времени.
Скорости биохимических реакций сбалансированы, за счет чего обеспечивается стационарное состояние организма. С одной стороны, изменение скорости какой-либо реакции, обусловленное воздействием факторов окружающей среды или особенностями развития организма, может быть причиной развития патологии. С другой стороны, при воздействии неблагоприятных факторов изменение скоростей реакций лежит в основе защитной и компенсаторной функций организма. Физиотерапевтические методы лечения основаны на изменении условий протекания реакций (локальное понижение/ повышение температуры), а фармакотерапевтические методы – на введении веществ, влияющих на скорость реакции.
Механизм реакции – последовательность и характер стадий химических реакций. По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Все биохимические реакции – сложные. Сложные реакции подразделяются на параллельные, последовательные, сопряженные и цепные.
Химические реакции многообразны и протекают с разной скоростью. Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени в определённом объёме или на определённой поверхности. (Концентрация - содержание вещества в единице объёма).
Если реакция протекает идеально, то для оценки скорости достаточно пользоваться понятием средняя скорость. В этом случае рассматривают изменение концентрации вещества за некоторый промежуток времени и относят это изменение к единице времени V = ±(c2-c1)/(τ2-τ1)=±Δc/Δτ.. Важно знать, по какому веществу оценивается скорость реакции. Если это исходное вещество, то концентрация его убывает V= - Δc/Δτ. Если контроль ведут по продукту реакции, то концентрация его возрастает V= + Δc/Δτ.
Однако в химической кинетике принят и другой способ оценки скорости химической реакции. Рассматривают характер графика c = f(τ) и скорость определяют по тангенсу угла наклона прямой к оси времени, т.е. Δс/Δτ = tg α.(рис1) Если реакция протекает сложно, то для оценки протекания химического процесса пользуются понятием истинная скорость химической реакции. Её можно определить математически и графически. Истинная скорость – это скорость реакции в данный момент времени. Причём в разные моменты она разная. Чем меньше рассматриваемый промежуток времени, тем точнее определяется скорость химической реакции.
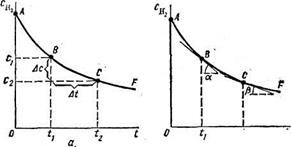
|
Математическое выражение скорости представляет собой производную концентрации во времени: Vист=± dc/dτ. В этом случае концентрация контролируемого вещества вполне определённа и её выражают в моль/л.
Рис. 1. Изменение во времени t концентрации Сн реагирующего вещества: а—к понятию о средней скорости реакции; б —к понятию об истинной скорости реакции
Скорость реакции зависит от многих факторов. Основными параметрами, которые приходится учитывать почти во всех процессах, являются концентрация реагентов (площадь соприкасающихся фаз), температура, давление и действие катализаторов. Рассмотрим влияние этих параметров на скорость реакции.
Молекулы могут взаимодействовать лишь при столкновении. Чем чаще эти столкновения, тем быстрее пойдет реакция. Из этого следует, что для увеличения числа вероятных столкновений необходимо в данной системе увеличить количество молей реагирующих веществ, т. е. увеличить их концентрации. Чем больше столкновений произойдет между молекулами в единицу времени, тем больше будет скорость реакции, значит, количество столкновений зависит от числа молекул в единице объема, т. е. от молярной концентрации веществ.
Влияние концентрации на скорость химической реакции выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ.
Так как скорость реакции А + В → D пропорциональна произведению концентраций веществ CА и CВ, то можно записать v = k CАCВ, где k — коэффициент пропорциональности, позволяющий учитывать различие между единицами измерения скорости и концентрации. В то же время коэффициент k, или константа скорости, указывает долю столкновений, которые приводят к осуществлению реакции. Если принять, что CА = CВ = 1 моль/л, тогда V=k. Поэтому константа скорости — это скорость реакции при концентрациях реагирующих веществ, равных единице. Если в реакцию вступает п молекул вещества А и т молекул вещества В nА + mB=gD, то коэффициенты п и т являются показателем степеней для концентраций соответствующих молекул и тогда закон действующих масс можно записать v=k CА n CВ m.
Константа скорости k не зависит от концентраций веществ. Закон действующих масс применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют и твердые вещества, концентрация которых постоянна, то скорость реакции изменяется только в зависимости от концентраций газов или растворенных веществ.
Молекулярность и порядок реакций. Число молекул, участвующих в элементарном акте химического взаимодействия, определяет молекулярность реакции. По этому признаку различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Реакции с молекулярностью больше трех практически не встречаются, так как вероятность столкновения даже трех молекул уже очень мала.
Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс.
Так, реакция СuО(к) + Н2 (г) = Сu (к) + Н2О (г) относится к реакциям первого порядка, так как уравнение закона действующих масс запишется следующим образом: v=kC(H2), а реакция H2 + I2 = 2HI относится к реакциям второго порядка, так как уравнение закона действующих масс имеет вид v =kC(H2)C(I2).
Молекулярность реакции - этомолекулярно-кинетическая характеристика системы, а порядок реакции определяет зависимость скорости от концентрации. Если при многостадийном процессе уравнение реакции отражает лишь исходное: и конечное состояние системы, не раскрывая механиз м процесса, то порядок реакции не совпадает с ее молекулярностью. Так, разложение N2O5 происходит согласно стехиометрическому уравнению 2N2O5=4NO2+O2, где для соблюдения баланса масс необходимо иметь две молекулы исходного соединения. Но экспериментально подтверждено, что данная реакция имеет первый порядок. На основании этого можно представить следующие стадии реакции:
N2O5=N2O3+O2
N2O3 + N2O5=4NO2
При этом скорость реакции в первой стадии значительно меньше, чем во второй.
Молекулярность реакции не совпадает с порядком и в тех случаях, когда разница между концентрациями реагирующих веществ весьма велика (например, гидролиз сахарозы в присутствии воды). Встречаются также реакции нулевого порядка (например, разложение аммиака на поверхности вольфрама), когда скорость не зависит от концентрации вещества в объеме, а также реакции дробного порядка (многостадийные процессы, где самые медленные стадии имеют разный порядок, однако их скорости соизмеримы). Поэтому нулевой или дробной молекулярности быть не может, так как эта характеристика относится к механизму реакции, а не к выражающему ее уравнению.
Зависимость скорости реакции от температуры. Энергия активации. Скорость химических реакций, как правило, при повышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом. При 20 °С скорость реакции практически равна 0 и понадобилось бы 54 млрд. лет, чтобы взаимодействие прошло на 15 %. При 500 °С для образования воды потребуется 50 мин, а при 700 °С реакция протекает мгновенно. Зависимость скорости реакции от температуры выражается в приближенной форме правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°С скорость реакции увеличивается примерно в 2 — 4 раза. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом реакции γ, т. е. выражается отношением константы скорости при температуре t + 100 к константе при температуре t:
γ (Δt/10)=kt+10/kt
Если кинетическая энергия сталкивающихся молекул достаточна для разрыва связей, то столкновение молекул приводит к перестройке молекул исходных веществ и образованию новых молекул. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуры число таких молекул возрастает, поэтому скорость реакции тоже должна увеличиваться. Более точно температурную зависимость скорости химических процессов выражает у равнение Аррениуса, которое имеет вид ln k = - (Ea/RT) + C (или k = Aexp(-Ea/RT). В этом уравнении константа скорости k связана с экспоненциальным выражением exp(-Ea/RT). Символ еxp означает основание натуральных логарифмов; R- универсальная газовая постоянная; Т — температура по шкале Кельвина; Еа — энергия активации, которая обычно предполагается постоянной величиной, не зависящей от температуры; А — коэффициент пропорциональности, иначе называется частотным множителем. Он указывает долю числа столкновений между молекулами, которая оканчивается реакцией.
Из уравнения Аррениуса следует, что правило Вант-Гоффа может выполняться для тех реакций, энергия активации которых лежит в пределах 84—170 кДж/моль. Современные исследования показали, что этот интервал значительно больше и находится в пределах 40 – 400 кДж/моль.
Чтобы понять, как применяется понятие энергии активациик конкретным химическим реакциям, рассмотрим реакцию взаимодействия водорода с йодом. В реакцию могут вступать только те молекулы, которые обладают повышенной энергией, позволяющей преодолеть активационный барьер. В реакции Н2 с I2 должны разорваться связи в Н •• Н и I •• I для образования HI. В определенный момент времени при сближении активных молекул, обладающих достаточной энергией для преодолениявзаимного отталкивания электронных облаков, возникает переходное состояние системы, отвечающее образованию промежуточного соединения, называемого активированным комплексом. Переходное состояние характеризуется тем, что промежуточный продукт имеет сходство как с начальными продуктами реакции, так и с конечными; связи между атомами в молекуле водорода еще не разорвались, а уже начала формироваться связь Н—I:

Координата реакции
Рис.2. Диаграмма потенциальной энергии (кДж/моль)
Разность энергий начального и конечного состояний системы равна тепловому эффекту реакции ΔН: ΔН = Е'А-Е"А.
Энергия активированного комплекса обычно выше энергии начального и конечного состояний системы. Можно сказать, что энергия активации — это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции. Из рис. 2 видно, что затраченная на активацию молекул энергия выделяется полностью или частично при образовании продуктов реакции. Если при этом энергии выделится больше, чем это необходимо для активации молекул, то реакция экзотермическая, если меньше — то эндотермическая.
Катализ
Скорость химических реакций может возрастать не только при увеличении концентрации реагирующих веществ или температуры системы, но и под влиянием катализаторов. Вещества, которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству, называют катализаторами. Процесс увеличения скорости реакции с помощью катализатора называется катализом, а реакции, в которых скорость изменяется в результате введения в реакционную смесь катализаторов, называются каталитическими.
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, различают гомогенный и гетерогенный катализ. Гомогенными катализаторами обычно могут быть растворы кислот, оснований, солей (прежде всего d-элементов— Сr, Mn, Fe, Со, Ni и др.). Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород в присутствии ионов Cr2O72-, WO42-, МоО42-.
При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах и разделены между собой поверхностью раздела (в качестве примера можно привести окисление SO2, до SO3 в присутствии катализатора, находящегося в твердой фазе). Катализаторы отличаются избирательностью, что зависит не только от природы катализатора, но условий его применения.
Механизм действия катализатора различен. Наиболее часто встречается катализ, при котором катализатор ускоряет скорость взаимодействия за счет образования промежуточных соединений. При взаимодействии этих продуктов высвобождается катализатор, количество которого остается неизменным.
Процесс образования промежуточных соединений с участием катализаторов является примером гомогенного катализа. В общем виде процесс выглядит следующим образом: А+В К АВ.
Из-за высокой энергии активации скорость реакции вещества А с В без катализатора ничтожно мала. Допустим, что катализатор легче реагирует с веществом А, чем исходные А и В между собой: A + K = AK
Возможность такого взаимодействия можно объяснить более низкой энергией активации при образовании АК. Промежуточный продукт АК, в свою очередь, легко реагирует с веществом В из-за иной природы веществ и малой энергии активации: AK + B = AB + K.
Таким образом, роль катализатора сводится к снижению энергии активации.
Биохимические реакции в растениях и животном организме ускоряются биологическими катализаторами, называемыми ферментами. Они представляют собой либо высокомолекулярные белки, либо сочетание белков с соединениями небелковой природы. Каждый фермент характеризуется высокой избирательностью по отношению к каждому конкретному процессу. Если учесть, что в организме человека протекает более 10 000 различных биохимических процессов, то понятно, насколько велика роль ферментов. Например, окисление сахара в организме протекает примерно в 106 раз быстрее, чем при той же температуре в водном растворе под влиянием кислорода. В сложной цепи биохимических процессов окисления сахара в организме участвует несколько ферментов, каждый из которых катализирует отдельную стадию.
Лекция 4.
ХИМИЧЕСКОЕ И ФАЗОВОЕ РАВНОВЕСИЕ
Обратимые и необратимые реакции. Некоторые химические реакции прекращаются до того, как исходные вещества прореагируют полностью. Например, взаимодействие эквимолярных количеств водорода с йодом протекает при 350 °С до тех пор, пока не образуется 80 % HI от теоретически расчетного: H2+ I2 ↔ 2HI.
Если HI нагревать при 350 °С, то происходит разложение на исходные Н2 и I2, однако процесс протекает таким образом, что образуется 10% Н2 и 10% I2, остальные же 80% HI не разлагаются: 2HI↔H2 + I2
Следовательно, при 350 °С осуществляются два процесса: прямая реакция, при которой из H2 и I2 образуется HI, и обратная реакция, в результате которой образовавшийся HI частично разлагается на исходные H2 и I2 Прямая и обратная реакции характеризуют состояние химического равновесия, т. е. системы, в которой не изменяется состав реагирующих веществ, если условия реакции остаются постоянными.
Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов реакции, при котором энтропия системы имеет максимальное, а изобарно-изотермический потенциал – минимальное значение.
Реакции, протекающие одновременно в двух противоположных направлениях, называются обратимыми. В обратимой реакции при одинаковых условиях достигается состояние равновесия независимо от того, из каких веществ исходят. При записи подобных реакций вместо знака равенства пользуются противоположно направленными стрелками (↔).
Рассмотрим взаимодействие магния с хлороводородом: Mg+2HCl=MgCl2 + H2 ↑.
Эта реакция сопровождается образованием хлорида магния и водорода. Если попытаться осуществить обратную реакцию, т. е. пропускать водород через раствор MgCl2, то металлический магний и НС1 не получатся. Следовательно, данная реакция протекает только в одном направлении и поэтому называется необратимой.
Изменение энергии Гиббса в химической реакции, протекающей в растворе, будет зависеть не только от температуры и давления, но и от количества каждого из веществ, входящих в состав раствора. Поэтому очень часто пользуются значением μi, представляющим собой частную производную энергии Гиббса по массе i-го вещества, при условии постоянства температуры и давления системы, а также масс остальных компонентов. Величина μi называется химическим потенциалом.
Когда две системы с различными химическими потенциалами вступают во взаимодействие, то происходит выравнивание потенциалов за счет изменения массы (концентрации) веществ. Давление уравновешивается за счет изменения объема. Поэтому химический потенциал является движущей силой химических реакций. Если эти процессы происходят в гомогенной системе, то они приводят к установлению химического равновесия; в гетерогенной же среде имеет место фазовое равновесие.
Константа химического равновесия. Самопроизвольное протекание обратимых химических реакций происходит до известного предела, т.е. до установления химического равновесия. Концентрации исходных веществ и продуктов реакции при этом остаются неизменными и называются равновесными. В условиях химического равновесия скорость прямой реакции равна скорости обратной.
Например, для реакции mA + nB → pC + qD скорость прямой реакции v1= k1 CАm CBn, скорость обратной реакции v2=k2 CCp CDq. Как только обе скорости становятся одинаковыми, в системе устанавливается динамическое равновесие, и дальнейшее изменение концентраций всех участвующих в реакции веществ прекращается. Итак, в состоянии химического равновесия скорости прямой и обратной реакций равны:
v1=v2, k1 CАm CBn =k2 CCp CDq. → Kp= CCp CDq/ CАm CBn
Это уравнение есть математическое выражение закона действующих масс, которому подчиняется система в состоянии равновесия: частное от деления произведения равновесных концентраций исходных веществ и продуктов реакции является величиной постоянной и называется константой равновесия Кр
Константа равновесия — важнейшая характеристика химического взаимодействия, так как позволяет судить о полноте протекания реакции. Для необратимых процессов Кр →∞. Если же Кр=0, то это указывает на полное отсутствие химического процесса. Достижению химического равновесия иногда препятствуют некоторые факторы, причиной которых является специфика самого процесса. Проиллюстрируем это на примере реакции горения водорода: 2Н2 + О2 = 2Н2О
При нормальных условиях газовая смесь водорода с кислородом может существовать бесконечно долго, так как в этих условиях они практически не реагируют между собой. Такое состояние не является равновесным, поскольку для протекания реакции между Н2 и О2 требуется внешнее воздействие. Если эту смесь поджечь, то произойдет мгновенное взаимодействие с образованием пара воды. Охлаждение этой системы до прежней температуры не возвращает ее в исходное состояние, так как новое состояние (образование воды) является термодинамически более устойчивым. Если состояние системы постоянно во времени, но при изменении внешних условий в системе происходит необратимый процесс, то такое состояние называется заторможенным (ложным) равновесием. Заторможенные равновесия характерны для твердофазных систем.
Истинное химическое равновесие при отсутствии внешнего воздействия неизменно во времени, а после внешнего воздействия система может вернуться в прежнее состояние. При истинном химическом равновесии ΔG = 0, т. е. значение свободной энергии минимально. При заторможенном равновесии ΔG < 0.
Константа равновесия и энергия Гиббса. Константа химического равновесия зависит от природы реагентов, от температуры и связана с изменением стандартной энергии Гиббса ΔG° химической реакции уравнением ΔG°= -RT lnK*
Уравнение * позволяет по значению ΔG° определить К, а следовательно, и равновесные концентрации. Отсюда следует, что чем значительнее убыль энергии Гиббса, т. е. чем сильнее сдвинуто равновесие в сторону продуктов реакции, тем больше значение константы равновесия. При высоких отрицательных значениях ΔG° в равновесной смеси преобладают продукты взаимодействия. Если же ΔG° > 0, то в равновесной смеси преобладают исходные вещества.
Объединяя уравнения ΔG = ΔH – T · ΔS и ΔG°= -RT lnK через величину ΔG, получим -RT lnK = ΔG° = ΔH0 – T · ΔS0
Это уравнение позволяет по значениям ΔH0 и ΔS0 вычислить константу равновесия и степень равновесного превращения.
Очевидно, что константа равновесия в значительной мере зависит от температуры. Для эндотермических процессов повышение температуры соответствует увеличению константы равновесия, для экзотермических — ее уменьшению. От давления (если р не очень велико) константа равновесия не зависит.
Смещение химического равновесия. Принцип Ле Шателье. Состояние химического равновесия при изменении условий (температуры, давления или концентрации) может сместиться либо в сторону образования продуктов реакции, либо в сторону исходных веществ. Влияние, оказываемое на равновесную систему каким-либо внешним воздействием, можно предсказать, пользуясь принципом Ле Шателье (принципом подвижного равновесия): если на систему, находящуюся в равновесии, воздействовать извне, то в системе усилится то из направлений процесса, которое противодействует данному воздействию. Например, реакция окисления SO2 до SO3:
2SO2 (г)+О2 (r) = 2SO3 (г), ΔH = —396,1 кДж/моль
Реакция образования SO3 сопровождается выделением теплоты, т. е. является экзотермическим процессом. Обратный процесс, т. е. разложение SO3 до исходных веществ, является эндотермическим. Если при установившемся равновесии повышать температуру, то это воздействие сместит равновесие в ту сторону, которая идет с поглощением теплоты. Таковым является разложение SO3.
Так как при равновесии соблюдается условие ΔН = TΔS, то изменение температуры приводит к изменению и ΔН. При повышении температуры в системе усиливается действие энтропийного фактора (TΔS > 0), т. е. усиливается эндотермический процесс. При понижении температуры действие энтропийного фактора ослабевает и начинает преобладать экзотермический процесс.
Влияние давления определяется изменением объема, которое происходит в ходе реакции. В данном примере по мере образования SO3 давление системы будет понижаться, поскольку из каждых двух молекул SO2 и одной молекулы О2, образуются только две молекулы SO3. Следовательно, при изменении давления равновесие будет смещаться в ту сторону, которая противодействует данному изменению; при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа, а уменьшение давления смещает равновесие в сторону образования большего числа молекул. Из этого следует, что в рассматриваемой равновесной системе увеличение давления сместит реакцию в сторону образования SO3.
При изменении концентрации компонентов равновесной системы значение константы равновесия остается неизменным, однако само равновесие смещается, так как при этом создаются более благоприятные условия для протекания прямой пли обратной реакции. Увеличение концентрации SO2 или О2 (или одновременно и того и другого) сместит реакцию в сторону образования SO3, как процесса, приводящего к уменьшению концентрации SO2 и О2. Если по мере образования из реакционной среды удалять SO3, то равновесие тоже сдвинется вправо.
Таким образом, если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции. Аналогичный результат может быть достигнут путем удаления из системы продуктов реакции.
Знание принципов химического равновесия, основанных на правиле Ле Шателье, имеет очень большое практическое значение, поскольку дает возможность контроля химических реакций как в лаборатории, так и в промышленности. Необходимо отметить, что данный принцип применим только к системам, находящимся в состоянии истинного химического равновесия.
Лекция 5
СТРОЕНИЕ АТОМА. ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ И СТРОЕНИЕ МОЛЕКУЛ
1 Периодический закон и периодическая система элементов Д. И. Менделеева
Д. И. Менделеев в 1869 г. положил в основу классификации химических элементов величину атомной массы элемента. Он расположил все известные тогда элементы в порядке возрастания их атомных масс и при этом обнаружил связь свойств химических элементов с их атомными массами. Д. И. Менделеев сформулировал периодический закон.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
На основе периодического закона Д. И. Менделеев создал периодическую систему химических элементов. Современная периодическая система содержит 117 химических элементов. Каждый химический элемент занял определенное место (клетку) в периодической системе и получил свой порядковый номер (атомный номер). В каждой клетке таблицы Менделеева кроме химического знака элемента указан его порядковый номер и относительная атомная масса.
Известно много вариантов построения периодической системы. Чаще используютдве формы: короткую и длинную.
Строение атома
Причину периодического изменения, сходства и различия свойств элементов объяснила теория строения атома, созданная в XX в.
В 1911 году Резерфорд предложил ядерную модель строения атома. По этой теории атом состоит из ядра, которое имеет положительный заряд, и электронов, которые движутся вокруг ядра. Совокупность электронов в атоме называется его электронной оболочкой. Диаметр атома - величина порядка 10-10 м, а диаметр ядра - величина порядка 10-14 – 10-15 м.
В 1913 г. английский ученый Д. Мозли обнаружил, что число электронов в электронной оболочке атома равно заряду ядра или порядковому номеру элемента в периодической системе Z. В 1932 г. советские ученые Д. Д. Иваненко и Е. Н. Гапон и, независимо от ниx, немецкий ученый В. Гейзенберг создали протонно-нейтронную теорию строения ядра. Согласно этой теории ядро атома состоит из протонов и нейтронов. Протон р - это частица с массой, равной 1 а. е. м., и зарядом + 1. Нейтрон n – это электронейтральная частица массой, близкой к массе протона. Ч исло протонов в ядре атома также равно порядковому номеру элемента в периодической системе Д. И. Менделеева.
Масса атома А равна сумме масс всех частиц, которые входят в атом:
А = масса протонов + масса нейтронов + масса электронов.(Ar = Z + N)
где Ar – относительная атомная масса элемента, Z – число протонов (или порядковый номер элемента в периодической системе); N – число нейтронов.
Протоны,нейтроны, электроны - это элементарныечастицы. В настоящее время известно околодвухсот элементарныхчастиц, обладающихразными свойствами(массой, зарядом и другими).
Изотопы
Относительные атомные массы большинства элементов в периодической системе представляют собой дробные числа. Это можно объяснить существованием атомов одного и того же элемента с разной массой. Разновидности атомов одного элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами, называются изотопами. Относительная атомная масса элемента в периодической системе элементов Д. И. Менделеева - это среднее арифметическое масс атомов его изотопов.
Химические свойства всех изотопов одного элемента одинаковы. Значит, химические свойства элементов зависятот заряда ядра атома, ане от атомной массы. Т.е. Химический элемент - это совокупность атомов с одинаковым зарядом ядра.
Не нашли, что искали? Воспользуйтесь поиском: