
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
КЛАСИФІКАЦІЯ ЗА АГРЕГАТНИМ СТАНОМ
1. Аерозолі (Г-Р) 5. Суспензії (Р-Т)
2. Аерозолі (Г-Т) 6. Тверді піни (Т-Г)
3. Піни (Р-Г) 7. Тверді емульсії (Т-Р)
4. Емульсії (Р1 – Р2) 8. Тверді суспензії (Г-Т)
Найбільшу цікавість викликають колоїдні розчини. Їх отримують двома методами: дисперсійним та конденсаційним.
Дисперсійний метод – отримання колоїдних систем подрібненням більш грубих за розміром часток до колоїдного ступеня дисперсності. Існують наступні засоби подрібнення часток: механічне дроблення – у ступці, дроблення за допомогою колоїдних млинів; електродиспергування металів; дроблення ультразвуком, тощо.
При дисперсійному методі позначається так званий ефект Ребіндера. На подрібнення матеріалу завжди затрачається велика кількість енергії. Роботами професора МГУ Петра Олександровича Ребіндера (1898-1972) та співробітників встановлено, що в присутності малої кількості речовини, здатної адсорбуватися в мікрощілинах матеріалів, знижується їх пружність та міцність, в наслідок чого зменшуються зовнішні зусилля на подрібнення. Цей ефект використовується при бурінні, обробці металів, тощо.
Конденсаційний метод – укрупнення часток шляхом з’єднання (конденсації) атомів під дією залишкових ван-дер-ваальсовських сил притягання в агрегати з колоїдним ступенем дисперсності. Конденсацію розчинів можна викликати різними фізичними та хімічними факторами: зниженням температури (туман), заміною кращого розчинника на гірший, тощо.
Отримані будь-яким способом колоїдні розчини необхідно стабілізувати, тобто додати речовини, що створюють захисні адсорбційні шари навкруги часток. Роль стабілізаторів можуть виконувати молекули та іони, що є продуктами взаємодії речовини дисперсної фази з дисперсійним середовищем, або спеціальні добавки речовин: ВМС, мила, електроліти (найчастіше), тощо.
Після стабілізації колоїдні розчини необхідно очистити від домішок. Процес очистки золів називається діалізом. В теперішній час очистку золів проводять в спеціальних приладах – електродіалізаторах, основною частиною яких є напівпроникна перетинка, що не пропускає великі частки золів і пропускає розчини стабілізаторів-електролітів.
Властивості колоїдних систем поділяють на три основних групи: молекулярно-кінетичні, оптичні та електрокінетичні.
Молекулярно-кінетичні властивості колоїдних розчинів якісно не відрізняються від аналогічних властивостей колоїдних розчинів, є тільки якісні відмінності. МКТ розглядає колоїдні розчини як приватний випадок справжніх розчинів, в яких дисперсна фаза відіграє роль розчиненої речовини, а дисперсійне середовище – роль розчинника. Колоїдним розчинам властиві наступні якості:
1. Броунівський рух – виражається в тому, що частки дисперсної фази, під впливом молекул дисперсійного середовища, що знаходяться в тепловому русі, приходять в стан безперервного хаотичного руху. Вперше воно було виявлено у 1827 році англійським ботаніком, монахом Т. Броуном, який спостерігав рух пилку рослин у воді. Броунівський рух властивий часткам будь-яких речовин, коли їх розміри достатньо малі. Чим менші частки, тим інтенсивніше спостерігається броунівський рух. Особливо помітний він у часток колоїдного ступеня дисперсності. В окремі моменти часу частина ударів молекул рідини о частки дисперсійної фази виявляється нескомпенсованою, внаслідок чого частки здійснюють пробіжи в самих різноманітних напрямках. Інтенсивність броунівського руху зростає із зростанням температури. Разом с тим, воно не залежить від часу – тривалості існування системи. Вивчення броунівського руху мало велике філософське значення, так як воно підтвердило реальність існування молекул.
2. Дифузія – мимовільний процес вирівнювання концентрацій молекул, іонів або колоїдних часток під впливом їх безладного теплового руху (у колоїдних системах – броунівського руху). Дифузія - незворотний процес і супроводжується переносом речовини із місць з більшою концентрацією до місць з меншою. Дифузія можлива лише в системах з невирівняною концентрацією і закінчується з настанням рівноваги, тобто з досягненням рівномірного розподілу часток по всьому об’єму. Кількісно процес дифузії виражається рівнянням:
m = D 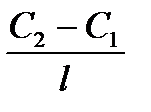 St
St
де m – кількість речовини, що дифундує, D – коефіцієнт дифузії, С2-С1 – змінення концентрації в двох шарах системи, l – відстань між двома шарами, тоді величина С2 – С1/l називається градієнтом концентрації; S – величина площі поперечного перетину, t - час дифузії.
Фізичний смисл коефіцієнту дифузії можна усвідомити, коли прийняти всі величини рівними 1. Тоді m=D, тобто коефіцієнт дифузії D дорівнює кількості речовини, що дифундує крізь 1 м2 за 1 секунду при градієнті концентрації 1 кмоль/м3 при даній температурі. У 1906 році Ейнштейн встановив залежність між коефіцієнтом дифузії та іншими величинами:
D = 
де R – універсальна газова постійна, T – абсолютна температура, NA – постійна Авогадро, h - в'язкість розчинника, дисперсного середовища, або газу, p - відношення довжини окружності до її діаметру (3,14), r – радіус часток, що дифундують, або молекул.
З рівняння видно, що коефіцієнт дифузії, який характеризує її швидкість, зворотно пропорційний розміру часток, що дифундують. З цієї причини при одній і тій самій температурі швидкість дифузії в колоїдних системах в сотні і тисячі разів менша за швидкість в справжніх розчинах. Знаючи коефіцієнт дифузії, модна визначити розміри часток.
3. Зсув – його відчувають частки внаслідок броунівського руху та дифузії. Відстань, на яку пересувається колоїдна частка по розчину в даному напрямку за час t, називається середнім зсувом і позначається D. Ц. Величину можна знайти дослідним шляхом. Німецьким фізиком Альбертом Ейнштейном та польським хіміком Маріаном Смолуховським у 1906 році було знайдено зв’язок середнім зсувом частки за час t та коефіцієнтом дифузії:
D=Ö2Dt
4. Осмотичний тиск - p. В колоїдних системах він вираховується за формулою:
p= N 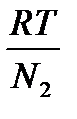
у зв’язку з тим, що у колоїдних часток концентрація – це кількість часток в одиниці об’єму.
Отже, при постійній температурі осмотичний тиск прямо пропорційний кількості часток в одиниці об’єму справжнього розчину, що беруть участь в тепловому русі, або кількості колоїдних часток в одиниці об’єму, що беруть участь в броунівському русі. Осмотичний тиск колоїдних розчинів малий і с трудом піддається вимірюванню.
У золів також відмічено невелике значення інших величин, що характеризують молекулярно-кінетичні властивості: пружність пари, зниження температури замерзання, підвищення температури кипіння.
Оптичні властивості колоїдних систем якісно відрізняються від оптичних властивостей справжніх розчинів. В основі їх лежить розсіювання та поглинання (абсорбція) світла колоїдними частками. Коли частки великі, їх розмір більший за довжину хвилі падаючого світла, розсіювання викликається відбиттям та переломленням падаючих на частки світлових хвиль. Такий вид розсіяння обумовлює, наприклад, мутність суспензій, емульсій, видиму неозброєним оком. Розсіяння світла колоїдними частками пов’язано з явищем дифракції – огинанням часток і розсіянням їх у різних напрямках. Поглинання світла залежить від природи речовини. Одні речовини поглинають всі промені падаючого світла, інші – тільки деякі (вибіркова абсорбція), треті – прозорі, або білі тіла – не поглинають промені взагалі.
До оптичних властивостей належать:
1. Опалесценція – поява деякої мутності та різниця в забарвленні золю в минаючому та відбитому світлі. Так, наприклад, золі сірки, каніфолі та хлориду срібла мають в минаючому світлі червонувато-жовтий відтінок, а у відбитому – голубуватий.
2. Забарвлення – пов’язано з вибірковою абсорбцією дисперсною фазою світлових хвиль, а також з дифракцією. Більшість золів мають забарвлення, інтенсивність якого в багато разів вища за забарвлення справжніх розчинів. Так, золь Fe(OH)3 має в 20 разів більш інтенсивне забарвлення, ніж розчин фуксину тієї ж концентрації, а золь золота – в 400 разів. Яскраве забарвлення дорогоцінного каміння викликана вмістом в них золів дорогоцінних металів.
3. Ефект Фарадея – Тіндаля – вперше Майкл Фарадей на золі золота, а потім – англійський фізик Х1Х сторіччя Джон Тіндаль винайшли, що коли пропускати крізь золь збоку пучок світла, то можна спостерігати появлення характерного світлового конусу. Утворення такого конусу можна спостерігати від променя прожектору на темному небі, від променя сонця, що проникає в темну кімнату, коли в ній знаходиться багато пилу, тощо.
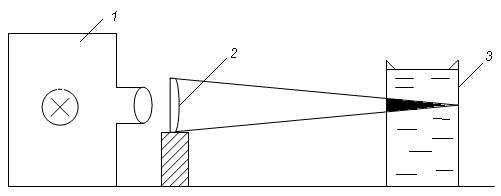
Кількісну характеристику цих явищ надав англійський фізик, член Лондонського королівського товариства Джон Уїльям Релей (1842 – 1919):
I = IoK 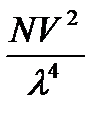
де Io- інтенсивність падаючого світла, К – постійна величина для даного золю, що залежить від різниці показників переломлення дисперсної фази no та дисперсійного середовища n, V- об’єм частки, N- кількість часток, що розсіюється о одиниці об’єму, l- довжина хвилі падаючого світла.
Оптичні властивості колоїдних систем лежать в основі побудови ультрамікроскопу та нефелометричного методу аналізу. За їх наявністю можна зробити висновок, чи справжній, чи колоїдний розчин перед нами.
Крім того, на поява якісно нових оптичних властивостей колоїдних розчинів завдяки зміни розміру часток, може служити чудовою ілюстрацією до одного з законів філософії – закону переходу кількісних змін до якісних.
Наявність електрокінетичних властивостей колоїдних систем було доведено дослідом Рейса у 1808 - 1809 роках. В грудку сирої глини він помістив дві скляні трубки, на дно яких насипав сирого піску. Трубки заповнив водою і в них занурив електроди, підключені до джерела току. При пропусканні електричного струму Рейс помітив через деякий час, що в анодній трубці рівень води знизився і в ній з’явились частки глини (муть), а в катодній – рівень води підвисився і вода залишилась прозорою. Виявилось, що частки глини набувають негативний заряд завдяки адсорбції гідрат-іонів ОН-. Іони Н+ пересувались до катоду. О основі виникнення електрокінетичних властивостей лежить поява на колоїдних частках подвійного електричного шару. До них відносяться:
1. Електрофорез – явище пересування твердих часток в електричному полі відносно нерухомої рідини до електроду, знак якого протилежний заряду часток золю.
2. Електроосмос – спрямований рух рідини до електроду, знак якого однаков із зарядом часток твердої фази. Обидва явища – електрофорез та електроосмос – було доведено дослідом Рейса.
3. Виникнення z - потенціалу (електрокінетичного потенціалу) – переміщаючись в електричному полі, частка захоплює за собою адсорбційний шар рідини і протиіони, що містяться в ньому, які нейтралізують частину заряду поверхні. Надлишок заряду і визначає z- потенціал. Його розраховують за формулою:
z  - для часток сферичної форми
- для часток сферичної форми
z  =
= 
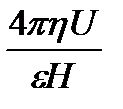 - для часток циліндричної форми
- для часток циліндричної форми
де p- відношення довжини окружності до її діаметру (3,14), h - в'язкість середовища, e - діелектрична проникність середовища, U –0 електрофоретична швидкість часток, H – градієнт потенціалу (Е/1). Звідси розрахувати електрофоретичну швидкість можна за формулами:
U = 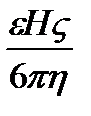 - для часток сферичної форми
- для часток сферичної форми
U = 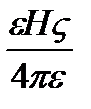 - для часток циліндричної форми
- для часток циліндричної форми
Явища електрофорезу та електроосмосу використовують в техніці: при виготовленні та сушінні цегли, при просоченні пористих матеріалів, тощо.
Дисперсна фаза колоїдних розчинів (золів) утворена колоїдними частками, що називаються міцелами. Міцела має складну будову. Дисперсна фаза колоїдних розчинів практично нерозчинна в дисперсній фазі. Тому колоїдний розчин можна отримати реакцією обміну.
Міцела – електрично нейтральна колоїдна частка, здібна до самостійного існування. Вона визначає всі основні властивості колоїдних систем.
Розглянемо будому міцели золю йодиду срібла.
В залежності від речовини, що знаходиться у надлишку, міцела золю має таку будову:
· Надлишок AgNO3
{(mAgI)* nAg+*(n-x)NO3-}x+*xNO3-
ядро________________
гранула__________________
міцела
· Надлишок KI
{(mAgI)* nI-*(n-x)K+}x-*xK+
ядро________________
гранула__________________
міцела
Наявність однойменного заряду у всіх часток даного золю є важливим фактором його стійкості. Заряд протидіє злипанню та збільшенню часток, тобто коагуляції. Коагуляцію можна визвати підвищенням температури, доданням електроліту, тощо. Для початку справжньої коагуляції необхідно додати до золю деяку мінімальну кількість електроліту, яка називається порогом коагуляції:
 .
.
Чим більший заряд коагулюючого іону, тим сильніше виражена його коагулююча здібність і тим менший поріг коагуляції (правило Шульце – Гарді).
Питання для самоперевірки
1. Що називається дисперсною системою?
2. Чим відрізняються колоїдні розчини від справжніх?
3. Якими методами отримують колоїдні системи?
4. Дайте характеристику властивостей колоїдних систем.
5. Яка будова міцел золів?
6. Що називається коагуляцією? Яки причини її викликають? В чому сутність пептизації?
7. Що називається емульсією? Як їх отримують? Використовують?
Тема: Розчини вмс.
Мета: Вивчити основні характеристики ВМС і способи визначення молекулярної маси ВМС
План
1.Характеристика розчинів ВМС
а) порівняння розчинів ВМС із золами;
б) порівняння розчинів ВМС з дійсними розчинами
2. Набухання ВМС
3. Висолювання
4. Застигання
5. В'язкість розчинів ВМС
6. Способи визначення молекулярної маси ВМС
ВМС – це речовини, що володіють молекулярною масою від декількох тисяч до декількох мільйонів атомних одиниць мас. Такі молекули називаються макромолекулами. До ВМС відносяться: білкові речовини, крохмаль, целюлоза, каучук, шовк і так далі.
По деяких властивостям вони схожі із золами, а саме:
1. Розмір часток у ВМС відповідає колоїдній мірі дисперсності (10-6 – 10-7 см);
2. часток їх затримуються напівпроникними перегородками при діалізі;
3. порівняно невелика швидкість дифузії;
4. під впливом зовнішніх чинників здатні коагулювати.
Довгий час тому розчини ВМС відносили до золів. Проте золі – гетерогенні системи, в той час, як розчини ВМС гомогенні. Вони мають ряд відмінностей від золів:
1. ліофільность, тобто здатність часток взаємодіяти з молекулами розчинника, унаслідок чого такі розчини утворюються мимоволі шляхом необмеженого набухання, перехідного в розчинення;
2. оборотність розчинення ВМС – якщо випарити розчинник, а потім до сухого залишку знов додати його, знову отримують розчин ВМС;
3. концентрація ВМС може досягати високих значень, унаслідок чого може бути визначене осмотичний тиск;
4. як завгодно довго зберігають агрегатівную стійкість, тобто ці системи знаходяться в стійкій термодинамічній рівновазі;
5. ефект Фарадея – Тіндаля виявляється не зовсім чітко;
6. до розчинів ВМС застосовно правило фаз, а до золів – ні.
7. Розчини ВМС подібні дворйним рідким системам (Ж1-Ж:2), а золи – суспензоїди.
Розчини Вмс в одних умовах утворюють дійсні розчини, а в інших – колоїдні. Проте розчини ВМС мають ряд специфічних властивостей, обумовлених присутністю в них макромолекул сильно витягнутої форми:
1. підвищена в'язкість;
2. драглиста;
3. набухання і ін.
Таким чином, розчини ВМС – проміжна ланка між золами і дійсними розчинами.
НАБУХАННЯ ВМС
Процес розчинення ВМС супроводжується явищем набухання – це мимовільний процес поглинання ВМС низькомолекулярної рідини – розчинника, що приводить до значного збільшення маси і об'єму узятого зразка. Сучасна теорія розглядає набухання і розчинення як процес змішування двох рідин – розчинника і ВМС, що знаходиться в переохолодженому стані. При набуханні ВМС молекули розчинника проникають углиб його. Цьому сприяє нещільна структура ВМС, що складається з ниткоподібних і зігнутих макромолекул, переплетених один з одним. Молекули низькомолекулярної рідини, проникаючи углиб, заповнюють вільний простір між макромолекулами, відсовуючи їх один від одного і ослабляючи міжмолекулярну взаємодію. «Щілини», що утворилися, заповнюються новими молекулами розчинника. В результаті збільшується об'єм і маса зразка. Так, наприклад, при набуханні желатин у воді об'єм збільшується в 14 разів.
Якщо перешкоджати збільшенню об'єму, розвивається значний тиск – тиск набухання.
Характеризується набухання велічиной міри набухання, виразимою у відсотках:
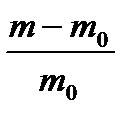
Де m0 – маса зразка до, m - після набухання.
Розрізняють необмежене і обмежене набухання. При необмеженому набуханні макромолекули, досить відсунуті один від одного, починають відриватися і переходити в розчин. Так набухають каучуки в бензолі нітроцелюлоза в ацетоні, білок у воді. Обмежене набухання розчиненням не закінчується. При всіх температурах каучук набухає обмежено в органічних розчинниках. Це пояснюється наявністю в структурі полімеру зв'язків між макромолекулами. Желатину у воді набухає при кімнатній температурі обмежено, а при підвищенні температури – необмежено.
Набухання ВМС носить виборчий характер. Воно спостерігається лише в рідинах з близькою до них хімічною будовою. Відбувається в декілька стадій:
1 – невелика кількість полярних молекул розчинника взаємодіє з полярними групами ВМС. Процес супроводиться виділенням теплоти набухання і стискуванням системи (об'єм набряклої речовини виявляється менше сумарного об'єму ВМС і поглиненої рідини).
2 – велика кількість молекул розчинника упроваджується в проміжки між макромолекулами вже без виділення теплоти.
На міру і швидкість набухання впливають:
1.природа розчинника;
2.природа ВМС;
3.температура;
4.тиск;
5.рН середовища;
6.присутність сторонніх речовин, особливо електролітів;
7.ступень подрібнення;
8.«вік» речовини.
Роль набухання велика. При травленні відбувається набухання харчових речовин. Набуханням пояснюють скорочення м'язів, утворення пухлин, еластичність стебел рослин. Важливу роль грає набухання в процесі приготування їжі, різних склеювальних речовин: клейстеру, лаків.
ВИСОЛЮВАННЯ ВМС
Висолювання – це виділення в осад розчиненої речовини, що викликається добавкою до розчину великих кількостей нейтральних солей. Якщо для коагуляції золів потрібна нікчемно мала кількість електролітів, то для висолювання ВМС витрачається дуже велика кількість солей. Крім того, коагуляція пов'язана з пониженням z- потенціалу, а висолювання – з порушенням сольватной зв'язку між макромолекулами ВМС і розчинником, тобто десольватації. Це приводить до поступового пониження розчинності ВМС і зрештою - випаданню його осідань.
По дії, що висолює, іони електролітів розташовуються в ліотропні ряди:
Аніони: С2О42-> SО42->СН3СОО- > Cl- > Br- > I- > СNS-
Катіони: Li+ > Nа+ > К+ >Rb+ >Сs+; Мg2+ >Са2+ > Sе2+ > Ва2+.
Дія посилюється справа наліво. Чим більше довжина молекул і молекулярна маса ВМС, тим легше відбувається висолювання.
Коагуляція ВМС часто відбувається у формі застигання. При цьому осад не утворюється, а вся система втрачає тягучу, переходячи в особливий проміжний стан, званий гелем, або драглем. Воно може відбуватися:
1. в результаті прояву між молекулами, що зближуються, сил міжмолекулярного тяжіння;
2. за рахунок об'єднання макромолекул, що відбувається під впливом водневих зв'язків, що виникають між ними;
3. під впливом добавок сторонніх речовин, сприяючих освіті додаткових хімічних зв'язків в молекулах ВМС.
Залежно від природи речовин, гелі бувають крихкими або еластичними (драглі). По своїй дії аніони розташовуються в ряд застигання, аналогічний ліотропним рядам. На швидкість застигання впливає рН середовища. Найбільшу швидкість воно має в ізоелектричній крапці. Крім того, на процеси впливає концентрація ВМС, температура, наявність домішок інших речовин, особливо електролітів.
Володіючи великою стійкістю по відношенню до дії електролітів, розчини ВМС, будучи доданими в певній кількості до золів, підвищують їх агрегатівную стійкість. Це явище отримала назва захисної дії, або явища захисту. Захищений золь може існувати в у розчині у більш великих концентраціях, чим незахищений. Інколи вони стають оборотними. Захисна дія залежить від: природи речовини і природи що захищається їм золя. Кількісно воно характеризується так званим золотим числом, яке виражається мінімальним числом міліграм сухого ВМС, яке оберігає 10 см3 червоного гідрозоля золота від зміни забарвлення при додаванні до нього 1 см3 10% розчину хлориду натрію.
Не нашли, что искали? Воспользуйтесь поиском: