
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ХИМИЧЕСКОЙ РЕАКЦИИ В ИНТЕРВАЛЕ ТЕМПЕРАТУР
(4 часа)
1. ЦЕЛЬ РАБОТЫ
Экспериментальное определение стандартных термодинамических величин
2. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
При анализе металлургического производства достаточно часто приходится рассчитывать выход и состав фаз, растворимость металлов и других ценных компонентов, константы равновесия и т.п. Для решения этих задач необходимо знать термодинамические величины. Для наиболее распространенных соединений эти величины есть в справочниках. Но для малоизвестных соединений такие данные обычно отсутствуют. В этом случае металлургам приходится самим проводить термодинамические измерения.
Вспомним основные физико-химические понятия.
Энтальпия Н - термодинамическая функция, характеризующая тепловые эффекты процессов Значение энтальпии используют для расчетов тепловых балансов металлургических агрегатов Энтальпию при заданной температуре можно определить, зная ее стандартное значение (ΔН0298) и зависимость теплоемкости (Ср) от температуры {T}.

Теплоемкость Cр - количество теплоты, необходимое для нагревания единицы вещества на 1 К. Теплоемкости веществ при разных температурах измеряют опытным путем. Для расчетов используют не сами экспериментальные данные, а уравнения зависимости теплоемкости от температуры. Коэффициенты уравнения определяют методом наименьших квадратов, а зависимость теплоемкости от температуры представляют в виде
∆Cp = a + bT + cT2
Энтропия S - функция состояния системы и характеризуемая ее разупорядоченность. Зная стандартное значение энтропии (ΔS0298), можно определить ее значение при любой другой температуре

Свободная энергия Гиббса G - функция состояния, определяющая возможность проведения процесса при постоянных давлении и температуре (изобарный, изотермический процессы). Свободную энергию Гиббса можно рассчитать по формуле (уравнение Гиббса - Гельмгольца)
∆G0T=∆H0T - T∆S0T (1)
В данной работе предлагается опытным путем определить термодинамические функции одного или нескольких соединений. В небольшом интервале температур можно считать, что ΔH0T и ΔS0T постоянны. Тогда для определения ΔH0T и ΔS0T можно поступить следующим образом. Экспериментально найти ΔG0T в некотором интервале температур, затем, воспользовавшись уравнением (1), определить ΔH0T и ΔS0T как постоянные коэффициенты линейного уравнения. Следовательно, задача вычисления ΔH0T и ΔS0T может быть сведена к определению ΔG0T в некотором интервале температур. Рассмотрим теперь способ определения ΔG0T.
Предположим, что исследуемым веществом является Рb3O4. Пусть при нагревании он диссоциирует по схеме:
Рb3O4 = 3РbO +1/2 O2
Свободная энергия реакции диссоциации связана c активностью кислорода следующим образом
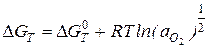 (2)
(2)
где: ΔG0T - стандартное значение свободной энергии при стандартном давлении, aO2 - активность кислорода, R - газовая постоянная.
Активность - это величина, при помощи которой учитывается отклонение от стандартного состояния. В идеальных газах, как правило, за стандартное состояние компонента принимают его состояние при парциальном давлении 1 атм. Тогда, активность кислорода будет равна парциальному давлению его в газовой фазе:
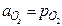
В момент наступления равновесия, когда прекращается выделение
кислорода, изменение свободной энергии процесса равно нулю, т.е.
 , тогда
, тогда
 (3)
(3)
Подставив в формулу (3) выражение активности кислорода, получаем:
 (4)
(4)
Таким образом, зная Р в равновесной смеси, можно рассчитать стандартное значение свободной энергии Гиббса. Константа равновесия химической реакции диссоциации равна:

В случае, если в системе произвели откачку (вакуумирование), то манометр покажет непосредственно давление кислорода. Если же в системе в начале опыта был воздух, то манометр покажет разницу между равновесным и исходным давлениями кислорода:
Pиск = 0,21 . Pатм.
Тогда, равновесное давление диссоциации оксида складывается из давления, измеренного манометром, и исходного парциального давления кислорода в атмосфере:
PO2 = Pман + 0,21 . Ратм
Таким образом, получим:

Подставив полученное значение Кр в формулу (5), окончательно будем иметь:
 (6)
(6)
Следовательно, измерив давление манометром и подставив его в выражение (6), мы можем рассчитать ΔG0T.
3. ПРИБОРЫ И УСТАНОВКИ
В данной работе предлагается определить равновесное давление кислорода прямым статическим методом, при котором диссоциация осуществляется в замкнутом объеме, а давление фиксируется манометром. Исследуемое вещество нагревается до заданной температуры и снимаются показания манометра.
Для нагрева исследуемого вещества используется печь сопротивления. Нагрев печи можно регулируется с помощью ВРТ (высокоточного регулятора температуры) осуществляется автоматически, причем нагрев вблизи заданной температуры происходит медленно по специальному закону регулирования с целью наиболее точного подхода к заданной температуре.
Для измерения температуры можно использовать как контактный метод (термометры сопротивления, термопары), так и бесконтактный метод (оптическая пирометрия).
Причем точность измерения температуры контактным способом более высокая. В качестве датчика температуры можно использовать платино-платиновородиевую или хромель-алюмелевую термопары. Термометры сопротивления рассчитаны на невысокий температурный интервал, обычно до 400 °С.
Оптические пирометры имеют меньшую точность измерения, чем термопары и используются в основном в промышленных условиях.
 Для измерения равновесного давления кислорода используют различные манометры ртутный, водный, спиральный. Ртутный манометр применяется для измерения сравнительно высоких давлений (от 01 кПа до 01 МПа). Точность измерения ртутным манометром 130 Па. Точность измерения водным манометром выше и составляет около 10 Па. Спиральный манометр - имеет такую же точность, как и ртутный.
Для измерения равновесного давления кислорода используют различные манометры ртутный, водный, спиральный. Ртутный манометр применяется для измерения сравнительно высоких давлений (от 01 кПа до 01 МПа). Точность измерения ртутным манометром 130 Па. Точность измерения водным манометром выше и составляет около 10 Па. Спиральный манометр - имеет такую же точность, как и ртутный.
Схема установки представлена на рисунке 2.1.
Для измерения равновесного давления кислорода в кварцевую ампулу 2, которая помещается в печь сопротивления 1, с помощью зажимов подвешивается тигель 6 с исследуемым веществом. Вакуумным краном 7 ампула соединяется с манометром 8. По достижении заданной температуры тигель помещается в реакционную зону и фиксируется показание манометра.
После проведения серии опытов рекомендуется осуществлять продувку ампулы для удаления остаточного кислорода, образовавшегося в результате реакции. Система для продувки воздухом может подключаться к вакуумному крану.
4. ПЛАНИРОВАНИЕ ЭКСПЕРИМЕНТА
Эксперимент предлагается провести в температурном интервалеот 400 до 550 °С, причем этот интервал необходимо разбить на определенное количество температурных точек, в которых будут сниматься показания манометра и спланировать, сколько опытов нужно провести при каждой температуре. При планировании следует учитывать, что зависимость ΔG(T) -линейная (уравнение 1).
Как уже отмечалось выше, в небольшом интервале температур с определенной достоверность можно полагать, что ΔH0T и ΔS0T не изменяются и зависимость ΔG(T) линейная. Поэтому необходимо, чтобы выбранный вариант отражал характер зависимости ΔG(T) и позволял с наибольшей точностью определить ΔH0T и ΔS0T. Ошибки в определении ΔH0T и ΔS0T записываются в виде:
 (7)
(7)
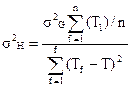 (8)
(8)
где: σG- среднеквадратичное отклонение определения G, n - количество опытов, Т - средняя температура опытов.
Для того, чтобы ошибка в определении ΔH0T и ΔS0T была минимальной, необходимо, во-первых, чтобы сам эксперимент был бы достаточно точен ( σG минимально), во-вторых, чтобы сумма квадратов отклонений температур была бы максимальной (это зависит от плана эксперимента). Необходимо выбрать приемлемый вариант для более точного расчета ΔH0T и ΔS0T. Кроме того, необходимо рассчитать априорную погрешность.
Таблица 2.1 - Экспериментальные данные
| № опыта | Температура, Т,°С | Масса навески, М, гр | Показания манометра, мм рт.ст. |
| - | |||
| - | |||
5. ПОРЯДОК ПРОВЕДЕНИЯ РАБОТЫ И УКАЗАНИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
1. Выбрать наиболее приемлемый метод определения термодинамических величин в заданном интервале температур
2. Подобрать надежные в эксплуатации и обладающие сравнительно высокой точностью приборы и составить схему установки
3. Выбрать необходимое количество опытов и условия их проведения
4. Провести эксперимент по выбранному плану
5. Обработать и проанализировать полученные данные
При выполнении работы необходимо, чтобы кран, соединяющий ампулу с манометром, при нагревании печи был открыт (соединен с атмосферой помещения).
6. ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
1. Рассчитываем ΔG0T по формуле (6), исходя из данных таблица 2.1. Затем определяем среднее значение ΔG1, (ΔG1 – ΔGT) и (ΔG1 + ΔGT) при каждой температуре.
2. Среднеквадратичное отклонение для одной температуры вычисляем по формуле.
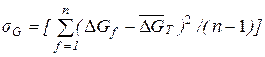
3. Коэффициент вариации w (относительная погрешность) определяем по
формуле:
w= σG /∆GT100%
4. Вычисляем общую погрешность:

где m общее число опытов, k - число температурных уровней.
Таблица 2.2 - Результаты вычислений
| № опыта | Т,K | ΔG1 | (ΔG1 +ΔGT) | (ΔG1 – ΔGT)2 |
| - - | ||||
| Среднее |
5. Ошибки в определении ΔH0T и ΔS0T вычисляются по формулам (7), (8). Исходя из метода наименьших квадратов, оценки истинных значений ΔH0T и ΔS0T можно определить, воспользовавшись формулами
а = (S3 S2 – S4 S1) / (m S2 – S1 S1),
b = (mS4 – S1 S3) /(|mS2 – S1S1),
где:

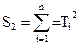
 (9)
(9)
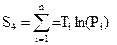
Постоянные коэффициенты связаны с термодинамическими функциями следующим образом:
а =ΔH0T /R,
b = ΔS0T /R
Способы использования метода наименьших квадратов могут быть различные. Так, для расчета ΔH0T /R и ΔS0T /R, которые равны а и b соответственно можно
- по формуле (9) -вручную сосчитать все суммы и по формулам найти а и b,
- рассчитать, составив программу расчета сумм, а и b на ЭВМ
- воспользоваться какими-либо стандартными программами (например, пакетом Excel)
6. Используя справочные данные стандартных термодинамических величин, необходимо рассчитать теоретические значения ΔH0T, ΔS0T, ΔG0T в заданном интервале температур. Далее следует сравнить теоретические данные с полученными экспериментальными и объяснить расхождения, если они имеются.
7. Сравнить априорную и апостериорную погрешности и сделать выводы.
7. ТРЕБОВАНИЯ К ОТЧЕТУ
Отчет должен содержать
1. Краткое теоретическое введение
2. План эксперимента
3. Схему экспериментальной установки
4. Экспериментальные данные (таблица 2.1)
5. Расчет термодинамических характеристик (таблица 2.2)
6. Анализ полученных расчетных значений
8. ЛИТЕРАТУРА
1. Ванюков А.В., Зайцев В.Я. Теория пирометаллургических процессов.- М.: Металлургия, 1993.- 384 с.
2. Жуховицкий А.А., Шварцман Л.А. Физическая химия. - М.: Металлургия, 1987.- 687 с.
9. КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие термодинамические функции определяют сродство металла ккислороду?
2. Оксид какого края области гомогенности (металлического или кислородного) будет иметь большую величину Ро2?
3. Как изменится величина равновесного давления кислорода при увеличении активности оксида в расплаве и почему?
4. Зависит ли равновесное давление кислорода в системе от массы навески?
5. Во всех ли типах систем энтальпия отражает тепловые эффекты процессов?
Не нашли, что искали? Воспользуйтесь поиском: