
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТИПОВЫЕ ТЕСТОВЫЕ ЗАДАНИЯ
1. Главное квантовое число характеризует ….
1) размер атомной орбитали
2) форму атомной орбитали
3) число атомных орбиталей на энергетических подуровнях атома
4) вращение электрона как бы вокруг своей оси
2. Орбитальное квантовое число характеризует ….
1) общую энергию электрона в атоме
2) форму атомной орбитали
3) ориентацию атомной орбитали в пространстве
4) наличие у электрона собственного момента количества движения
3. Магнитное квантовое число характеризует ….
1) средний размер орбиталей
2) число энергетических подуровней в атоме
3) ориентацию атомных орбиталей в пространстве
4) наличие у электрона собственного магнитного момента
4. Спиновое квантовое число характеризует ….
1) число энергетических уровней в атоме
2) орбитальный момент количества движения электрона
3) число атомных орбиталей на энергетическом подуровне
4) наличие у электрона собственного момента количества движения
5. Форму атомных орбиталей характеризует квантовое число ….
1) l 2) m l 3) ms 4) n
6. Размер атомной орбитали характеризует квантовое число ….
1) l 2) m l 3) ms 4) n
7. Возможные ориентации атомных орбиталей в пространстве характеризует квантовое число ….
1) l 2) m l 3) ms 4) n
8. Наличие у электрона собственного магнитного момента и момента количества движения характеризует квантовое число ….
1) l 2) m l 3) ms 4) n
9. Максимальное количество электронов на третьем энергетическом уровне атома равно ….
1) 2 2) 8 3) 18 4) 32
10. Количество подуровней на третьем энергетическом уровне атома равно ….
1) 1 2) 2 3) 3 4) 4
11. Количество орбиталей на третьем энергетическом уровне атома равно ….
1) 1 2) 4 3) 9 4) 16
12. Электронная конфигурация электронейтральных атомов с зарядом ядра +23 в основном состоянии выражается формулой ….
1) 1s22s22р63s23р63d24s3 2) 1s22s22р63s23р63d44s1
3) 1s22s22р63s23р63d54s0 4) 1s22s22р63s23р63d34s2
13. Порядковый номер химического элемента, валентные электроны атомов которого в основном состоянии описываются формулой 3s23р4, равен ….
1) 8 2) 10 3) 11 4) 16
14. Количество электронов в электронейтральном атоме серы, у которых m l = 0, равно ….
1) 3 2) 6 3) 9 4) 15
15. Количество электронов в электронейтральном атоме фосфора, у которых m l = +1, равно ….
1) 3 2) 6 3) 9 4) 15
16. Количество электронов в электронейтральном атоме марганца, у которых m l = –2, равно ….
1) 1 2) 5 3) 13 4) 25
17. Строение атомов иода в основном состоянии описывается сокращённой электронной формулой ….
1) [Kr] 5s25d55p5 2) [Kr]5s25р5 3) [Kr]5s25р4 4) [Kr]5s24d105р5
18. В электронейтральных атомах олова в основном состоянии валентные электроны описываются формулой….
1) 5s25р2 2) 5d25р2 3) 5s24d105р3 4) 5s25d105р2
19. Распределение электронов по энергетическим уровням в электронейтральном невозбуждённом атоме магния описывается набором цифр ….
1) 4, 6, 2 2) 2, 6, 4 3) 2, 8, 2 4) 2, 8, 4
20. Невозможной для атомов является электронная конфигурация ….
1) 2р1 2) 3s2 3) 2d4 4) 4f 3
21. Количество электронов на внешнем энергетическом уровне электронейтрального атома хлора в нормальном состоянии равно ….
1) 5 2) 6 3) 7 4) 8
22. Количество электронов на р -подуровне внешнего энергетического уровня электронейтрального атома брома в основном состоянии равно ….
1) 4 2) 5 3) 6 4) 7
23. Заряд ядра электронейтральных атомов, описываемых сокращённой электронной формулой [Ar] 4s23d5, равен ….
1) 20 2) 25 3) 30 4) 35
24. Количество полностью заполненных энергетических подуровней в электронейтральном невозбуждённом атоме германия равно ….
1) 5 2) 6 3) 7 4) 8
25. Количество полностью заполненных энергетических уровней в электронейтральном атоме кальция в основном состоянии равно ….
1) 4 2) 3 3) 2 4) 1
26. Химический элемент, в невозбуждённых электронейтральных атомах которого на энергетическом уровне М содержится 9 электронов, – это ….
1) калий 2) скандий 3) кальций 4) медь
27. Элемент четвёртого периода Периодической системы химических элементов Д.И. Менделеева, электронейтральные атомы которого содержат на d-подуровне по три электрона, – это ….
1) Мn 2) V 3) Sс 4) Сr
28. Суммарное количество электронов на s -орбиталях электронейтрального атома магния в основном состоянии равно ….
1) 2 2) 6 3) 8 4) 12
29. Максимальное количество неспаренных электронов на р-подуровнях атома любого химического элемента в основном состоянии равно ….
1) 3 2) 4 3) 5 4) 6
30. Количество неспаренных электронов в электронейтральном атоме кобальта в нормальном состоянии равно ….
1) 2 2) 3 3) 4 4) 5
31. Порядок размещения электронов на р-подуровнях невозбуждён-ных атомов химических элементов изображается схемой …
| 1) | ↑ | ↑ | ↑ | 3) | ↑↓ | ↑ | |||||
| 2) | ↑↓ | ↓ | 4) | ↑ | ↓ | ↑ | |||||
32. Порядок заполнения электронами орбиталей невозбуждённых атомов кислорода изображается схемой ….
| 1) | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 1s | 2s | 2р | |||||
| 2) | ↑↓ | ↑ | ↑↓ | ↑↓ | ↑ | ||
| 1s | 2s | 2р | |||||
| 3) | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ||
| 1s | 2s | 2р | |||||
| 4) | ↑↓ | ↑↓ | ↑↓ | ↑ | ↓ | ||
| 1s | 2s | 2р | |||||
33. р-Элемент, электронейтральные атомы которого в основном состоянии содержат наибольшее число вакантных орбиталей, – это ….
1) Аl 2) Si 3) Р 4) S
34. Возбуждённое состояние атомов магния описывается сокращённой электронной формулой ….
1) [Nе] 3s2 2) [Hе] 3s13р1 3) [Nе] 3s13р1 4) 3s13р1
35. Суммарный спин электронов электронейтрального невозбуждённого атома марганца равен ….
1)  2)
2)  3)
3)  4)
4) 
36. Порядок заполнения электронами орбиталей атомов серы в возбуждённом состоянии изображается схемой ….
| 1) | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ||||||||||
| 1s | 2s | 2р | 3s | 3р | 3d | ||||||||||||||
| 2) | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||||
| 1s | 2s | 2р | 3s | 3р | 3d | ||||||||||||||
| 3) | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↓ | ↑ | ||||||||||
| 1s | 2s | 2р | 3s | 3р | 3d | ||||||||||||||
| 4) | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||||||||
| 1s | 2s | 2р | 3s | 3р | 3d | ||||||||||||||
37. Суммарный спин электронов электронейтрального невозбуждённого атома германия равен ….
1) 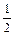 2) 1 3)
2) 1 3)  4) 2
4) 2
38. Число заполненных энергетических подуровней во фторид-анионе равно ….
1) 1 2) 2 3) 3 4) 4
39. Анионы брома в основном состоянии описываются электронной формулой ….
1) 1s22s22р63s23р63d104s24р6 2) 1s22s22р63s23р63d104s24р4
3) 1s22s22р63s23р63d104s24р5 4) 1s22s22р63s23р63d104s1
40. Катионы цинка в нормальном состоянии описываются электронной формулой ….
1) 1s22s22р63s23р63d10 2) 1s22s22р63s23р63d84s2
3) 1s22s22р63s23р63d104s24р2 4) 1s22s22р63s23р63d104s2
41. Наибольшее количество электронов имеет ….
1) электронейтральный атом натрия
2) ион алюминия
3) ион фтора
4) электронейтральный атом магния
42. Электронную оболочку электронейтральных невозбуждённых атомов одного из благородных газов имеют ионы ….
1) Са2+ 2) Сr3+ 3) Sn2+ 4) Мn2+
43. Частицами, имеющими такую же электронную конфигурацию, как невозбуждённые атомы аргона, являются ….
1) ионы кальция 2) нейтральные атомы калия
3) нейтральные атомы хлора 4) ионы натрия
44. Количество электронов в анионе серы равно ….
1) 14 2) 16 3) 18 4) 21
45. Согласно правилу Клечковского ….
1) в атоме не может быть двух электронов в одинаковых квантовых состояниях
2) 3 d -подуровень заполняется электронами после 4 s -подуровня
3) на 2 р -подуровне не может быть больше двух электронов
4) суммарный спин электронов одного энергетического подуровня атома в основном состоянии максимален
46. Количество нейтронов в атомах изотопов 1H, D и T соответственно равно ….
1) 1, 2, 3 2) 2, 3, 4 3) 0, 1, 2 4) 1, 1, 1
47. Количество нейтронов в атомах нуклида 52Cr равно ….
1) 24 2) 52 3) 28 4) 76
48. Количество нуклонов в атомах нуклида 197Au равно ….
1) 79 2) 118 3) 197 4) 276
49. Количество протонов в атомах нуклида марганца-55 равно ….
1) 20 2) 25 3) 80 4) 55
50. На энергетическом подуровне атома, характеризующимся орбитальным квантовым числом, равным двум, максимально может находиться … электронов.
1) 2 2) 8 3) 10 4) 14
КРОССВОРДЫ
№ 1
По горизонтали: 5. Химический элемент, в ядре атома которого имеется 11 протонов. 8. Химический элемент третьего периода с относительной атомной массой 24 а.е.м. 9. Химический элемент с латинским названием "феррум". 10. Zn. 11. Химический элемент второго периода IVA группы. 12. Химический элемент, в электронейтральном атоме которого имеется 53 электрона. 15. Мn. 16. Химический элемент VA группы с относительной атомной массой 31 а.е.м.
По вертикали: 1. Mg. 2. Химический элемент третьего периода, в атоме которого на внешнем электронном слое имеется 4 электрона. 3. Латинское название химического элемента Ag. 4. Химический элемент первого периода. 6. Химический элемент IIIА группы, в атоме которого имеется три энергетических уровня. 7. N. 8. Сu. 13. Химический элемент с атомным номером 50. 14. Химический элемент, в ядре атома которого имеется 16 протонов.
№ 2
По горизонтали: 2. Частица, которая состоит из ядра и электронов. 5. Указывает место элемента в Периодической системе химических элементов Д.И. Менделеева. 7. Число протонов в ядре атома магния. 8. Положительно заряженная частица в ядрах атомов химических элементов. 10. Химический элемент, электронейтральные атомы которого содержат по 17 электронов. 12. Частица в атомном ядре. 13. Число энергетических уровней в атоме азота. 14. Что образует горизонтальная последовательность элементов в Периодической системе химических элементов Д.И. Менделеева.
По вертикали: 1. Название модели атома, которая была создана Э. Резерфордом. 3. Пространство вокруг атомного ядра, где наиболее вероятно нахождение электрона. 4. Отрицательно заряженная частица в атоме. 6. Центральная часть атома. 9. 35Сl и 37Cl. 11. Наименьшая частица вещества, обладающая его химическими свойствами.
№ 3
По горизонтали: 5. Самопроизвольное излучение атомами, обусловленное распадом их ядер. 8. Наименьшая частица вещества, обладающая его химическими свойствами. 9. Горизонтальный ряд Периодической системы химических элементов Д.И. Менделеева. 11. Швейцарский физик, который в 1925 году установил, что на атомной орбитали может находиться не более двух электронов. 12. Место локализации нейтронов в атоме. 13. Учёный, сформулировавший одно из правил распределения электронов в атоме. 14. Вид атомов с одинаковым зарядом ядра.
По вертикали: 1. Пространство вокруг атомного ядра, где заключено около 90 % электронного облака. 2. Название модели строения атома, предложенной Э. Резерфордом. 3. Частица атома. 4. Создатель гипотезы, согласно которой атом подобен положительно заряженной сферической капле, в которую вкраплены отрицательно заряженные частицы. 6. Система взаимодействующих элементарных частиц. 7. Историческое название элементов побочных подгрупп Периодической системы химических элементов Д.И. Менделеева. 10. Способность электрона вести себя и как волна, и как частица.
№ 4
По горизонтали: 2. Его номер совпадает с числом энергетических уровней в атомах химических элементов. 3. Положительно заряженная часть атома. 4. Частица, способная проявлять корпускулярно-волновую двойственность. 7. Учёный, внёсший в планетарную модель атома квантовые представления. 9. Химический элемент, электронейтральный атом которого содержит 30 электронов. 11. Учёный, установивший особенность расположения электронов на атомных орбиталях. 12. Химический элемент IIIБ группы. 13. Химический элемент, в ядре атома которого содержится 33 протона. 14. Направление вращения электрона.
По вертикали: 1. Показывает место элемента в Периодической системе химических элементов Д.И. Менделеева. 2. Нуклон. 5. Пространство вокруг атомного ядра, где наиболее вероятно нахождение электрона. 6. d-Элемент V группы Периодической системы химических элементов. 8. Химический элемент, ядра атомов которого имеют заряд +88. 10. Химический элемент, в ядре атома которого имеется 20 протонов.
№ 5
По горизонтали: 4. Создатель планетарной модели атома. 7. Число энергетических уровней в атоме натрия. 8. Электронейтральная частица. 9. Направление вращения электрона. 10. Швейцарский физик. 12. Электрон как объект микромира. 14. Значение главного квантового числа для химических элементов первого периода. 15. Учёный, выдвинувший постулаты о том, что электрон движется вокруг атомного ядра по определённым стационарным орбитам. 16. Благородный газ. 17. Форма изображения строения электронных оболочек атомов при помощи квантовых ячеек.
По вертикали: 1. Характеристика электрона. 2. Русский учёный, создатель теории распределения электронов в атоме по энергетическим уровням и подуровням. 3. Создатель одной из первых научных гипотез о строении атома. 5. Модель, согласно которой атом состоит из ядра и движущихся вокруг него электронов. 6. Пространство вокруг атомного ядра, где наиболее вероятно нахождение электрона. 10. Нуклон. 11. Химический элемент с зарядом ядра атома +9. 13. Образован электронами, которые имеют близкие значения энергии.
ОТВЕТЫ НА УПРАЖНЕНИЯ
Не нашли, что искали? Воспользуйтесь поиском: