
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПОРАЖЕНИЕ ОРГАНОВ ПОСЛЕ ТЯЖЕЛОГО ШОКА
Полиорганная недостаточность.
После тяжелых, особенно продолжительных стадий шока и последующей стабилизации
кровообращения и дыхания, наблюдается повторное ухудшение состояния больных вследствие
поражения почек, легких, печени и других органов, возникают патологические зависимости,
некоторые из них представлены на рисунке 12.
• Нарушенная перфузия сердца ухудшает его функцию, что сопровождается снижением
сердечного выброса. Это в свою очередь снижает перфузию всех органов, включая
кровоснабжение самого сердца.
• Нарушение перфузии поджелудочной железы приводит к образованию пептидов, которые
подавляют функцию сердца. На рисунке 13 показан пример подавления сократимости
сердечной мышцы циркулирующим фактором депрессии миокарда (ФДМ, MDF в
английской аббревиатуре).
• Недостаточная перфузия печени стимулирует анаэробный обмен и значительное
образование молочной кислоты, что способствует развитию метаболического ацидоза,
который в свою очередь нарушает функцию сердечно-сосудистой системы. В этих условиях
печень становится неспособной инактивировать активные медиаторы и токсины,
циркулирующие в кровотоке.
• Сниженная перфузия кишечника приводит к нарушению барьера слизистых (кишечник
очень чувствителен к ишемии), бактерии могут попасть в кровоток и вызвать присоединение
септического шока. Кроме того, нарушение слизистых вызывает дополнительную потерю
жидкости из организма.
• Плохая перфузия почек нарушает их функцию, тем самым прекращается выведение кислых
метаболитов, что способствует системному ацидозу. Сниженная перфузия может привести к
тубулярному некрозу и накоплению токсических метаболитов.

Рис. 12. Некоторые патологические зависимости в повреждениях органов, приводящие
к полиорганной недостаточности при шоке.
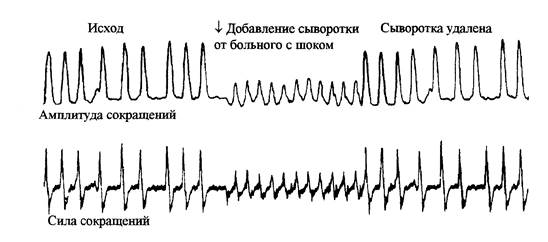
Рис. 13. Депрессивное действие сыворотки от больного с острым септическим шоком
на амплитуду и силу сокращений перфузируемого сердца.
Эти патологические зависимости являются причиной возникновения после выхода из шока состояния, характеризуемого как полиорганная недостаточность или мультисистемная органная недостаточность. Как правило кишечник, заполненный грам-отрицательными бактериями, рассматривается инициатором развития нозокоминаных пневмоний в постреанимационном периоде, а также септического состояния и полиорганной недостаточности. Тем не менее функции и других органов могут быть парализованы: сердца, почек, легких, печени, системы мононуклеарных фагоцитов, иммунной системы. В конечном счете может нарушиться функция мозга и возникнет кома. Полиорганная недостаточность - грозное осложнение, которое является часто причиной смерти. Мало больных, которым удалось выжить после возникновения недостаточности 3 органов. Недостаточность любой системы часто делает неэффективным обычные способы лечения, в этом случае нет однотипного
рецепта.
Легкие
Степень повреждения функции легких зависит от вида и тяжести шока. При септическом шоке в легочных артериях образуются агрегаты нейтрофилов, которые имеют тропность к повреждениям легочной ткани. Это проявляется резким увеличением проницаемости микрососудов легких - развивается отек легких даже при низком венозном давлении. При прогрессировании острого повреждения легких любого генеза клиническая картина описывается термином респираторный дистресс синдром (РДС). Развитие РДС сопряжено со смертностью более 50 %. РДС можно охарактеризовать как дыхательную недостаточность, связанную с интерстициальным отеком легких, возникающим из-за увеличенной проницаемости легочных капилляров. При этом повреждены как альвеолы, так и их капиллярная сеть. Клинически у больных развивается острая дыхательная недостаточность, увеличивается частота пульса. Лечение кислородом малоэффективно, рентген показывает диффузную инфильтрацию. Причины РДС представлены в таблице 10.
При дыхательной недостаточности газовый состав артериальной крови указывает на гипоксемию и обычно на гипокапнию. Последняя связана с левым сдвигом кривой диссоциации оксигемоглобина. При этом потенциально увеличен транспорт кислорода к тканям, поэтому цианоза может не быть, несмотря на гипоксемию.
Микроскопически обнаруживается, что часть альвеол замещена гиалиновыми мембранами, которые содержат фибрин, остатки клеток, погибший альвеолярный эпителий. Капилляры альвеолярной стенки повреждены, имеются геморрагии, происходит отложение фибрина на мембранах. Механизм повреждения альвеол (как эпителия, так и капилляров) вероятно комплексный. Если РДС развивается при искусственной вентиляции легких с содержанием кислорода более 40 %, то в основе лежит, по-видимому, токсический эффект кислорода, связанный с образованием свободных радикалов кислорода при его высокой концентрации. При септическом шоке повреждение первично начинается в альвеолярных капиллярах: скопившиеся в них активированные нейтрофилы являются источником свободных радикалов и гидролитических ферментов, которые вызывают повреждение и гибель эндотелиальных и эпителиальных клеток. Нейтрофилы активируются первично эндотоксинами и вторично через систему комплемента и хемотаксины (лейкотриены, фактор, активирующий
тромбоциты и др). Активированные лейкоциты и тромбоциты имеют тенденцию к агрегации и являются причиной микроэмболов, повышается их тенденция к краевому стоянию. В результате альвеолы заполняются экссудатом, фибробласты мигрируют и организуют его, воздух перестает поступать в альвеолы и развивается тяжелая дыхательная недостаточность.
Дыхательная недостаточность, при которой РаО2 < 8 кПа (60 мм Hg) с или без РаС02 >
6,7 кПа (50 мм Hg) требует перевода больного на искусственную вентиляцию легких.
Таблица 10.
Причины развития респираторного дистресс синдрома (РДС) в критических ситуациях.

Почки.
Снижение перфузии почек при шоке может произойти в течение нескольких минут. Гломерулярная фильтрация зависит от перфузионного давления и может прекратиться, если давление снижается до 60-50 мм Hg и даже раньше. При гиповолемии и шоке в кровоток выбрасываются системные вазоконстрикторы ренин-ангиотензиновой системы, автономной нервной системы, катехоламины, тромбоксан. Внутри почек действие вазоконстрикторов сбалансировано интраренальными простагландинами, которые обеспечивают определенный уровень почечного кровотока при системной вазоконстрикции. Поэтому не следует использовать при гиповолемии нестероидные противовоспалительные препараты, которые подавляют циклооксигеназу, участвующую в синтезе простагландинов, так как это может привести к резкому снижению гломерулярной фильтрации у больных с гиповолемией. Гомеостатические механизмы в почке направлены на задержку в организме Na и воды, чтобы
поддержать объем циркулирующей крови. В результате формируется мало мочи, в ней низкое содержание Na (менее 20 ммоль/л), но высокий удельный вес. Несмотря на то, что при этом может быть определенная задержка выведения азотистых продуктов (мочевины и креатинина), тем не менее это защитный механизм при гиповолемии, иногда его обозначают как «преренальная недостаточность». Снижение мочеотделения - характерная особенность шока, это связано в первую очередь с экстраренальными факторами. При лечении шока скорость мочеотделения - важный критерий успешного лечения, при этом причины олигурии те же - нарушение перфузии почек. Поэтому олигурия часто не патология, а компенсаторный механизм при гиповолемии, но есть пациенты, у которых уже в первые сутки лечения развивается острая почечная недостаточность. Больных с почечной недостаточностью надо различать, так как требуется разное лечение. Принципы лабораторной диагностики почечной недостаточности представлены на рисунке 14.
Важной функцией почек является участие в регуляции кислотно-основного состояния. За сутки почками удаляется до 75 ммоль ионов водорода, в основном в связанном виде с калиевыми солями фосфатного буфера и ионами аммония. При тяжелой почечной недостаточности соответственно падает способность почек удалять ионы водорода и электролиты - развивается ацидоз и гиперкалиемия.
Нормальные почки экскретируют 8 - 16 г азота в сутки, который на 85 % входит в состав мочевины (250 - 500 ммоль/сутки) и на 5 % в состав креатинина (9-15 ммоль/сутки). Мочевина, пропорционально профильтрованной в гломерулах, реабсорбируется в канальцах. Этот процесс поддерживается осмотическим градиентом между медуллярным и корковым веществом почек и относится к концентрирующему механизму почек. При сниженной перфузии тубулярная реабсорбция профильтрованной мочевины увеличивается, концентрация ее в плазме повышается. Креатинин, напротив, способен фильтроваться и секретироваться в канальцах из перитубулярных капилляров. Поэтому концентрация креатинина в плазме меньше меняется при гипоперфузии почек, чем мочевины. Непропорциональное повышение мочевины при шоке поддерживается также повышенным образованием мочевины в процессе протеолиза. Резкое увеличение креатинина может наблюдаться у больных с массивным повреждением мышечной ткани при травмах, ушибах, поражении электрическим током. В общем случае непропорциональное повышение мочевины в плазме по сравнению с креатинином – достаточно надежный показатель гиповолемического преренального состояния. Тем не менее наиболее общим случаем повышения концентрации мочевины в плазме является снижение перфузии
почек. При выраженной преренальной недостаточности в плазме повышается и креатинин.
Постренальная недостаточность, вызванная обструкцией мочевыводящих путей камнем. гипертрофированной простатой или причины, возникшей в результате травмы, практически
ничем не проявляется при лабораторном анализе мочи и сыворотки. Анализы существенно
меняются, если в результате разовьется собственно почечная недостаточность.
Механизм развития почечной недостаточности при шоке комплексный. В результате нарушения перфузии развивается ишемия почечной паренхимы. Медуллярная часть почки характеризуется очень высокой скоростью метаболизма и требует достаточно большого количества субстратов. Поэтому медуллярный кровоток может не восстановиться после успешного лечения гиповолемии. Продолжительная ишемия приводит к гломерулярной недостаточности из-за повреждения микрососудов. Бактериальные эндотоксины способны вызвать вазодилятацию после вазоконстрикции, связанной с действием симпатической нервной, ренин-ангиотензиновой систем и катехоламинов. Почки подвержены относительно высокому риску повреждений при сепсисе по сравнению с другими органами, так как они концентрируют как бактериальные эндотоксины, так и нефротоксические антибиотики, такие как аминогликозиды (гентамицин, канамицин, неомицин и др.), метатриксат, амфеторицин и т.д.
Ишемия и нефротоксические агенты могут блокировать тубулярный метаболизм и привести к повреждению тубулярных клеток, включая набухание клеток, потерю микроворсинок и клеточную десквамацию. Все это может вызвать обструкцию канальцев и появление характерных эпителиальных цилиндров в моче. Даже, если нет тубулярной блокады. повреждение канальцевых эпителиальных клеток приводит к нарушению реабсорбции. Этому типу поражений почек способствует большое количество белков в моче, таких как гемоглобин. миоглобин, миелоидные белки. Во время сниженной фильтрации увеличивается риск преципитации этих белков. Поэтому поддержание высокой скорости образования мочи введением в организм жидкостей требуется для снижения риска тубулярной блокады.
При почечной недостаточности в фазе олигурии или анурии характерными лабораторными показателями являются параллельное повышение в сыворотке мочевины и креатинина, увеличение концентрации Mg, Рнеорг. и ацидемия. Если моча образуется, то содержание в ней Na увеличено (более 20 ммоль/л), отношение Na/K более чем 1, осмолярность мочи близка к осмолярности сыворотки из-за нарушения концентрирующей способности почек В моче появляется белок (более 300 мг/л), в осадке присутствуют эпителиальные клетки и эпителиальные и даже эритроцитарныс цилиндры, может присоединиться гематурия. Почечная недостаточность может протекать с полиурией. При этом, несмотря на нормальное или даже повышенное образование мочи. в плазме увеличено содержание мочевины я креатинина. Это состояние может сопровождаться тяжелой печеночной недостаточностью или возникнуть перед олигурической стадией. Полиурическая почечная недостаточность имеет лучший прогноз, чем олигурическая.

Рис. 14. Алгоритм диагностики и лечения почечной недостаточности при шоке
Постоянно необходимо следить за обменом К, Na и водным балансом. Поддержание или восстановление нормального или даже повышенного образования мочи - основная задача предупреждения и лечения острой почечной недостаточности. У больных в критическом состоянии часто возникают противоречия в показаниях к введению жидкостей. С одной стороны, их нужно вводить, чтобы поддержать образование мочи, с другой стороны, это будет способствовать перегрузке сердца и легких, в которых возможно развитие отека. Роль лаборатории при этом заключается в точном и своевременном предоставлении данных клиницистам при ухудшении функции почек. Это можно сделать при постоянном исследовании и сопоставлении плазмы крови и мочи. Снижение экскреции Na и подъем мочевины в сыворотке - часто ранние признаки возникающей гиповолемии.
Гиперфосфатемия - общий признак у больных в критическом состоянии при острой почечной недостаточности, что связано со снижением почечной экскреции и выходом фосфатов из некротизированных тканей. Иногда у больных с полиурической почечной недостаточностью может иметь место гипофосфатемия. Гипермагниемия часто встречается при почечной недостаточности из-за снижения экскреции. Гипомагниемия может быть при нефротическом тубулярном поражении, что связано с нарушением тубулярной реабсорбции. Гиперкалиемия - основная биохимическая проблема при острой почечной недостаточности, концентрация К в плазме может достичь 6 ммоль/л, что ведет к нарушению сердечной деятельности и проявляется изменениями ЭКГ. У больных в критическом состоянии гиперкалиемия может возникнуть не только из-за острой почечной недостаточности, но и в связи с некрозом, размозжением тканей, гемолизом, ацидемией, а также тяжелой трансминерализацией. Постоянное лабораторное слежение за состоянием больных имеет большое значение в ранней диагностике и оценке эффективности лечения острой почечной недостаточности у больных в критическом состоянии.
Мозг
Повреждение мозга может быть генерализованным, в результате развивается кома, но может быть локальным. Основная проблема - это гипоксия и ишемия мозга, которые приводят к набуханию клеток (т.е. внутриклеточному отеку). В результате повышается внутричерепное давление, которое дополнительно уменьшает кровоснабжение мозга. Таким образом замыкается патологический круг.
Наиболее тяжелым нарушением деятельности мозга при повреждениях является развитие комы. Кома - бессознательное состояние, характеризующееся нечувствительностью к внутренним и внешним раздражителям. Больные как правило находятся в коме не более 2-4 недель. При прогрессировании кома переходит в состояние децеребрации. Достаточно много потенциальных причин развития комы, но наиболее часто - это структурные, метаболические или ятрогенные нарушения (таблица 11). Необходимо помнить, что кома даже у больных с повреждением мозга в определенной степени может быть связана с потреблением алкоголя и наркотических веществ.
Лабораторные исследования могут выявить причину комы и установить эффективность лечения, однако тяжесть комы определяется по клиническим показаниям: глазным, вегетативным, двигательным рефлексам. Лабораторный контроль должен включать оценку адекватности дыхания по газовым и кислотно-основным показателям крови и метаболический статус. Гипервентиляция со снижением РдСОз и последующим изменением рН крови может вызвать сужение сосудов мозга и ограничение мозгового кровообращения. Почечная компенсация рН происходит в течение 2-3 дней, в результате мозговой кровоток нормализуется. Внезапное прекращение гипервентиляции может привести к резкому повышению РаС02 и увеличению мозгового кровотока, что чревато отеком. Маннитол уменьшает отек мозга за счет осмотического эффекта. Так как маннитол экскретируется почками, то его повторные инфузии нужно контролировать по осмоляльности плазмы, которая должна быть в пределах 300 – 320 ммоль/кг.
Кишечник
При шоке кровоток в брыжейке уменьшается в результате системного вазоспазма и снижения сердечного выброса. Возникающее прогрессивное повреждение кишечника может привести к проникновению в систему циркуляции бактерий или их токсинов. Это является одной из предпосылок повреждения других органов, особенно легких. Вовлеченность кишечника в повреждения после шока рассматриваются как признак развития полиорганной недостаточности.
В здоровом кишечнике постоянная перистальтика предупреждает продолжительны контакт бактерий с мукозным слоем и уменьшает возможность для микроорганизмов достигать эпителий. Лимфоциты и макрофаги ассоциированы с эпителиальными клетками, они и лимфатические узлы мезентерия обеспечивают локальный иммунный ответ на пищевые антигены и бактерии кишечника. Секреторный IgA, продуцируемый В-клетками, внутри мукозного слоя селективно связывается с бактериями и предупреждает их адгезию к стенке. Бактерии и эндотоксины, которые достигают портального кровотока, инактивируются ретикулоэндотелиальной системой печени. Если же развивается ишемия кишечника, то защитные механизмы нарушаются. При остановке перистальтики происходит застой в кишечнике, отечность, слой слизистой отслаивается, появляются многочисленные геморрагии в стенке кишки, существенно увеличивается возможность для бактерий проходить через
кишечный эпителий., бактерии и эндотоксины могут преодолевать этот барьер и возникает системная эндотоксикоемия.
Через мукозный слой из кишечника поступает в организм большое количество субстратов, некоторая часть из них требуется собственно как внутрикишечные субстраты. К ним относятся глютамин и в качестве энергетических субстратов глюкоза и свободные жирные кислоты. Поэтому сохраняется необходимость энтерального питания у больных при длительном шоке на парантеральном питании.
В сердце после тяжелого шока возникают геморрагии в субэндокарде (механизм неясен), При геморрагическом шоке описаны так называемые «зональные повреждения». В этих зонах саркомеры чрезмерно сокращены, имеются очаги микротромбозов и микронекрозов. Как правило такие изменения возникают после периодов перенапряжения сердца с увеличением силы и частоты сокращений. Их связывают с действием высоких концентраций катехоламинов и обозначают как «адреналовый миокардит».
Не нашли, что искали? Воспользуйтесь поиском: