
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Якісні реакції на вуглеводи
Мета роботи: Вивчити властивості вуглеводів. Навчитися визначати концентрацію глюкози в сироватці крові за допомогою ортотолуїдинового реактиву.
Питання для самопідготовки:
1. Загальна характеристика вуглеводів. Значення для живих організмів.
2. Класифікація вуглеводів.
3. Характеристика моносахаридів. Їх значення і хімічні властивості (явище таутомерії, муторотації). Оксикарбонильні і циклічні форми.
4. Характеристика дисахаридів, їх фізичні і хімічні властивості.
5. Характеристика полісахаридів (крохмаль, целюлоза, гепарин).
6. Формули ксилози, рибози, дизоксирибози, арабінози, глюкози, фруктози, сахарози, мальтози, крохмалю, целюлози.
ТЕОРЕТИЧНА ЧАСТИНА
Вуглеводи (сахари) – група природних органічних сполук, які складаються з вуглецю, водню та кисню та відповідають загальній формулі -Сn(Н2О)n. Вуглеводи грають важливу роль в життєдіяльності організму. Функції вуглеводів в організмі: енергетична, структурна, захисна, гемостатична, антизгортуюча, гомеостатична, опорна, механічна, групоспецифічні речовини еритроцитів крові, осморегуляторна, знешкоджуюча, антиліпідемічна.
Вуглеводи класифікуються на моносахариди, олігосахариди та полісахариди.
Моносахариди – вуглеводи, які не можуть бути гідролізовані до більш простих форм. їх підрозділяють:
1. За кількістю вуглецевих атомів на триози (С3), тетрози (С4), пентози (С5), гексози (С6), гептози (С7);
2. По хімічній природі на альдози та кетози, які відповідно мають властивості альдегідів та кетонів.
Деякі представники моносахаридів:

D-рібулоза – проміжний продукт фотосинтезу. D-Фруктоза міститься у фруктових соках та меді, присутня у сахарозі і в рослинних полісахаридах. D-Рібоза – компонент РНК, АТФ та коферментів нуклеотидної природи. D-Дезоксирибоза - компонент ДНК. D-Глюкоза міститься у фруктових соках, в плазмі крові людини та тварин, входить до складу целюлози та крохмалю.
Хімічними реакціями моносахаридів є мутаротація, утворення глікозидів, відновлення та окислення, епімеризація. Вони можуть відновлювати окисли металів, тому як мають вільну альдегідну групу.
Більш складними вуглеводами є дисахариди. Вони складаються з двох залишків моносахаридів. При їх утворенні дві молекули моносахаридів утрачають частку води та з'єднуються між собою через кисень. їх загальна формула С12Н22О11. Фізіологічно важливими дисахаридами є мальтоза, сахароза, лактоза та трегалоза. До складу сахарози (міститься у цукровому буряку та цукровому троснику) входять залишки глюкози та фруктози, до мальтози (міститься у солоді) – залишки двох молекул глюкози, до лактози (молочний цукор) – галактоза та глюкоза.
Будова дисахариду сахарози:

Відновлювати окисли металів сахароза не може, тому як не має вільної альдегідної групи.
Полісахариди – найбільш складні високомолекулярні вуглеводи, побудовані з багатьох десятків і навіть сотень моносахаридних залишків, сполучених один з одним через кисень та утворюючих лінійні або гілчасті ланцюги. Загальна формула полісахаридів - (С6Н10О5)n.
Полісахариди побудовані з залишків моносахаридів одного типу, називаються гомоглікани. До них відносяться глікоген печінки (запасається в організмі людини у печінці та м'язах), крохмаль (міститься у злаках, картоплі, бобових), целюлоза (головний компонент структурної основи рослин), які побудовані з залишків глюкози. Полісахариди побудовані з залишків моносахаридів різних типів, називаються гетерогліканами. Сюди відноситься гепарин, гіалуронова кислота, хондроітинсульфат.
Полісахариди погано розчинні у воді (крохмаль, глікоген) або зовсім не розчинні у воді (целюлоза). Здібності відновлювати окисли металів полісахариди не мають. Вона з'являється лише після гідролізу полісахариду завдяки наявності в гідролізаті мальтози та глюкози.
В основному вуглеводи виконують енергетичну функцію. Головними джерелами енергії є глюкоза та глікоген. До того ж, із вуглеводів можуть синтезуватися ліпіди, деякі амінокислоти, пентози.
Добова норма вуглеводів у їжі складає 400-500 г. Основними вуглеводами їжі є: крохмаль та дисахариди – сахароза, лактоза, мальтоза.
Гідроліз крохмалю починається у порожнині рота за участю ферменту амілази слини до декстринів. Потім його гідроліз продовжується у верхньому відділі кишечнику під впливом панкреатичної амілази. В результаті з крохмалю утворюються дисахаридні залишки мальтози. Гідроліз всіх дисахаридів здійснюється на поверхні клітин кишечнику та каталізується специфічними ферментами: сахаразою, лактазою, мальтазою, які синтезуються в клітинах кишечнику.
З кров'ю воротньої вени більша частина глюкози із кишечника надходить до печінки, решта глюкоза через загальний кровообіг транспортується в інші тканини. Концентрація глюкози в крові у нормі піддержується на постійному рівні ті складає 3,33-5,55 мкмоль/л, що відповідає 80-100 мг в 100 мл крови. Транспорт глюкози в клітини носить характер полегшеної дифузії, але регулюється в багатьох клітинах гормоном підшлункової залози – інсуліном.
В організмі вуглеводи можуть піддаватися окисленню або використовуватися для синтезу глікогену – резервного вуглеводу тканин (печінки, м'язів, нервової тканини та ін.). Головним депо вуглеводів є печінка.
Вивчення енергетики м'язової діяльності показало, що при роботі м'язів відбувається розпад вуглеводів і утворення продуктів їх окислення. Особливо велика роль вуглеводів як джерела енергії в умовах недостатнього постачання тканинам кисню (гіпоксія) і при м'язовій діяльності великої інтенсивності, коли різко зростає потреба організму в кисні, яка не може бути повністю задоволена.
Окислення вуглеводів відбувається в 2 стадії. Перша стадія називається гліколізом. Вона полягає в неповному окисленні глюкози до двох молекул піровиноградної кислоти (аеробний гліколіз) або двох молекул молочної кислоти (анаеробний гліколіз). Всі десять реакцій гліколізу протікають у цитозолі та характерні для всіх органів та тканин. Друга стадія має назву окислювального циклу трикарбонових кислот (або циклу Кребса). Вона полягає в аеробному окисленні залишків піровиноградної кислоти (у виді ацетильних радикалів) до кінцевих продуктів окислення - вуглекислоти і води.
Обидва процеси – і гліколіз, і цикл Кребса – складаються із багатьох проміжних реакцій. Унаслідок цього енергія, яку містять в собі вуглеводи, звільняється поступово, перетворюючись у багаті енергією фосфорні сполуки – у кінцевому рахунку в аденозинтрифосфорну кислоту (АТФ).
Біохімічні перетворення глікогену і глюкози починаються з утворення гексофосфорних ефірів. Наступні перетворення цих ефірів під дією відповідних ферментів приводять до утворення з кожного глюкозного залишку двох молекул фосфогліцеринового альдегіду. При окисленні останнього утворюється багата енергією сполука – дифосфогліцеринова кислота, яка віддає свій макроергічний фосфорильний радикал АДФ:
ДфГлК + АДФ = ФГлК + АТФ.
Фосфогліцеринова кислота, яка при цьому виникає окислюється далі, що призводить до утворення нової, багатої енергією сполуки – фосфорєнолпіровиноградної кислоти, яка також використовується для утворення АТФ:
ФЄПВК + АДФ = ПВК + АТФ.
Подальша доля утвореної піровиноградної кислоти може бути різною в залежності від наявних в організмі умов.
Як вказувалося вище, окислювальний процес у гліколізі починається з окислення фосфогліцеринового альдегіду в дифосфогліцеринову кислоту. Це складний процес. У ньому, зокрема, бере участь НАД (нікотинамидаденіндинуклеотид), до якого приєднується водень (саме відібрання водню і складає сутність окислення, що відбувається). Протікання цього процесу забезпечується тим, що водень далі транспортується на кисень, і, таким чином, знову виникає окислена форма НАД.
В умовах неповного задоволення потреби організму в кисні цей останній процес різко обмежений, і в результаті накопичується відновлена форма НАД-Н2.Окислення її в анаеробних умовах здійснюється з одночасним відновленням піровиноградної кислоти. Завдяки наявності подвійного зв'язку піровиноградна кислота приєднує водень від відновленої форми НАД, перетворюючись у молочну кислоту:

Отже, молочна кислота є кінцевим продуктом гліколізу у відносно анаеробних умовах. Вміст її в крові за звичаєм складає біля 10 - 20 мг%, а в м'язах - 30-50 мг% і різко збільшується в результаті інтенсивної м'язової діяльності, що супроводжується, як правило, тим або іншим ступенем кисневої недостатності в тканинах. Наприклад, кількість молочної кислоти в крові і м'язах може досягати при цьому 200 - 250 мг%).
Молочна кислота є досить сильним фізіологічним подразником, який викликає зрушення рН, змінює проникність клітинних мембран, активність ферментів та ін.
Усунення молочної кислоти в організмі відбувається різними шляхами. У період відпочинку після м'язової діяльності біля 80% утвореної молочної кислот перетворюється в глікоген, а її 20% окислюється в піровиноградну кислоту і потім до вуглекислого газу і води в циклі Кребсу:

При задоволенні потреби організму в кисні (у стані спокою, при неінтенсивній м'язовій діяльності) піровиноградна кислота, що виникла в результаті гліколізу, піддається окислювальному декарбоксилюванню з утворенням ацетильного радикалу, який окислюється в циклі Кребсу.
Якщо за якоюсь причиною даний процес утруднений (наприклад, при нестатку вітаміну В1, який бере участь у побудові коферменту декарбоксилювання піровиноградної кислоти), то це призводить до накопичення піровиноградної кислоти в тканинах. Вміст її в м'язах за звичаєм складає від 1 до 3 мг%), а в крові – 0,8 - 1,5 мг%.
В аеробному гліколізі утворюється 10 молекул АТФ на 1 молекулу глюкози. Сумарний ефект аеробного гліколізу складає 8 молекул АТФ, тому як на початкових реакціях використовується 2 молекули АТФ. Подальше окислення двох молекул пірувату в загальних шляхах катаболізму супроводжується синтезом 30 молекул АТФ (по 15 молекул на кожну молекулу пірувату). Отже, сумарний енергетичний ефект аеробного розпаду глюкози до кінцевих продуктів складає 38 молекул АТФ.
В анаеробному гліколізі утворення двох молекул лактату з глюкози супроводжується синтезом двох молекул АТФ. Анаеробний гліколіз, незважаючи на невеликий енергетичний ефект є основним джерелом енергії для скелетних м'язів у початковому періоді інтенсивної роботи, тобто в умовах, коли постачання киснем обмежено.
Глюконеогенез– це синтез глюкози з невуглеводних попередників. У ссавців цю функцію виконує в основному печінка, у меншому ступеню – нирки та клітини слизової кишечника.
ПРАКТИЧНА ЧАСТИНА
Практичне значення роботи: за допомогою якісних реакцій можна визначати наявність вуглеводів у біологічних рідинах і тканинах організму. По зміні їх вмісту судять про захворюваність.Показником вуглеводного обміну з діагностичними цілями є вміст глюкози в крові і сечі. Підвищення рівня глюкози (гіперглікемія) є досить частим симптомом при різноманітних захворюваннях, насамперед пов'язаних із поразкою ендокринної системи (цукровий діабет, пухлини кори наднирників, гіперфункції щитоподібної залози, захворювання печінки, органічні поразки ЦНС).
Матеріали і реактиви: ортотолуїдиновий реактив, 3 %-вий розчин трихлороцтової кислоти, основний стандартний розчин глюкози – 27,80 ммоль/л, центрифуга, центрифужні пробірки, штатив із пробірками, водяна лазня, фотоелектроколориметр, кювети із шириною прошарку 10 мм.
Устаткування: Штатив із пробірками, піпетки, мікропіпетки, циліндри, колба, термостат (37° С), ФЕК, міліметровий папір.
Принцип методу:
1. Відновлення гідроксиду міді (II) глюкозою – реакція Фелінга. Усі моносахариди, а також більш складні цукри, що мають вільну альдегідну або кетонну групи, мають спроможність відновлювати метали в лужному середовищі. Метали при цьому відновляються з окисної форми в закисну або навіть до вільного стану.
2. Відновлення гідроксиду срібла глюкозою – реакція срібного дзеркала. Глюкоза відновлює аміачний розчин гідроксиду срібла, утворений при взаємодії нітрату срібла з гідроксидом натрію і водяного розчину аміаку до металевого срібла
3. Реакція Селіванова на фруктозу. При нагріванні фруктози (і інших кетогексоз) із соляною кислотою утворюється оксиметилфурфурол, що із резорцином дає з'єднання пофарбоване у вишнево-червоний колір. При великій концентрації спостерігається поява червоно-бурого осаду.
4. Проробити реакцію сахарози з реактивом Фелінга. У молекулі сахарози зв'язок між залишками глюкози і фруктози утворюється за рахунок двох глікозидних гідроксилів. Сахароза не має відновлювальних властивостей і дає негативну реакцію Фелінга, а також не відновлює аміачний розчин гідроксиду срібла.
5.Проробити реакцію сахарози з аміачним розчином оксиду срібла.
6. Гідроліз сахарози. Після гідролізу сахарози (кип'ятіння при наявності концентрованої сірчаної кислоти) утворюються моносахариди, що можна виявити за допомогою реакцій Фелінга і Селіванова.
7. Якісна реакція на крохмаль. Найбільш специфічна реакція на крохмаль – поява синього фарбування з йодом. Фарбування обумовлене амілозою. Фарбування зникає при нагріванні і відновлюється при охолоджені крохмального клейстеру.
8. Доказ відсутності відновлюючої спроможності крохмалю. Полісахариди не містять вільних редуційованих груп, тому вони не мають відновлюючої спроможності.
9. Кислотний гідроліз крохмалю.
10. Визначення концентрації глюкози в крові по кольоровій реакції з ортотолуідином. Глюкоза при нагріванні з ортотолуїдином у розчині трихлороцтової кислоти (ТХУ) дає синьо-зелене забарвлення, інтенсивність якого прямо пропорційна концентрації глюкози в крові.
Хід роботи:
1. Відновлення гідроксиду міді (II) глюкозою – реакція Фелінга: до 1-2 мл розчину глюкози доливають рівний об'єм реактиву Фелінга (складається з розчинів CuS04, NaOH і сегнетової солі). Суміш нагрівають до кипіння. Утворюється червоний осад оксиду міді (І).
2. Відновлення гідроксиду срібла глюкозою – реакція срібного дзеркала: у пробірку вносять 4 краплі розчину глюкози, 4 краплі аміачного розчину оксиду срібла і нагрівають. На стінці утворюється наліт срібла.
3. Реакція Селіванова на фруктозу: у пробірку поміщають крупинку резорцину, добавляють 2 краплі концентрованої НСl, 2 краплі розчину фруктози і нагрівають до кипіння. Поступово рідина забарвлюється в червоний колір.
4. Проробити реакцію сахарози з реактивом Фелінга.
5. Проробити реакцію сахарози з аміачним розчином оксиду срібла.
6. Гідроліз сахарози: у пробірку додають 1 мл розчину сахарози, добавляють 2 краплі концентрованої соляної кислоти і нагрівають на киплячій водяній лазні 15 хвилин. Потім суміш розділяють на 2 частини, з однією проробляють реакцію Фелінга, а з другою – реакцію Селіванова.
7. Якісна реакція на крохмаль: до декількох крапель крохмального клейстеру додають 1-2 краплі реактиву Люголя (розчин йоду з йодистим калієм).
8. Доказ відсутності відновлюючої спроможності крохмалю: у пробірку вносять 1 - 2 мл крохмального клейстеру і проробляють із ним реакцію Фелінга.
9. Кислотний гідроліз крохмалю: наливають у пробірку 3 мл крохмального клейстеру, 2 краплі концентрованої соляної кислоти і кип'ятять на водяній лазні 15 хвилин. Щоб визначити, чи відбувся гідроліз крохмалю, відбирають 3-5 крапель розчину і додають краплю реактиву Люголя. Якщо розчин не синішає, гідроліз закінчено. Відбирають у пробірку 1 - 2 мл гідролізату і проробляють із ним реакцію Фелінга.
Результати дослідів вносять у таблицю:
Таблиця 1
Результати якісних реакцій на вуглеводи
| № п/п | Назва досліду | Застосовувані реактиви | Поява фарбування | Що відкриває ця реакція |
10. Визначення концентрації глюкози в крові по кольоровій реакції з ортотолуідином: у дві центрифужні пробірки наливають по 0,9 мл розчину трихлороцтової кислоти, потім в одну з них вносять 0,1 мл сироватки крові, а в другу – 0,1 мл стандартного розчину глюкози, розведеного перед вжитком у 5 разів із концентрацією 5,55 ммоль/л. Вміст пробірок збовтують і центрифугують при 3000 об/хв 10 хвилин. У 2 пробірки відбирають по 0,5 мл надосадкової рідини і додають по 4,5 мл ортотолуїдинового реактиву. Пробірки поміщають у киплячу водяну лазню на 5 хвилин, охолоджують їх під струменем холодної води і вимірюють на ФЕКі оптичну щільність проб у кюветах проти контрольної проби з червоним світлофільтром (λ =600 - 650 нм).
При проведенні контрольної проби до 4,5 мл ортотолуїдинового реактиву доливають 0,5 мл трихлороцтової кислоти. Далі пробу обробляють так само, як і дослідну.
Розраховують глюкозу за формулою:
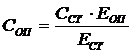
де Соп – конц. глюкози в дослідній пробі (ммоль/л); Сст - конц. глюкози в стандартній пробі, близька до фізіологічної (5,55 ммоль/л); Еоп - оптична щільність дослідної проби; Ест - оптична щільність розчину стандарту.
Нормальний вміст глюкози в сироватці крові коливається 3,33 - 4,99 ммоль/л.
Зробити висновки.
Контрольні питання:
1. Методи визначення концентрації глюкози.
2. Постійність концентрації глюкози і механізми, що забезпечують цю постійність.
3. Перетравлення вуглеводів у шлунково-кишковому тракті.
4. Нервова й ендокринна регуляція вуглеводного обміну.
5. Синтез глікогену. Розщеплення глікогену.
6. Гліколіз. Реакції субстратного фосфорилювання.
7. Цикл трикарбонових кислот (цикл Кребса).
8. Дихальний ланцюг. Характеристика і структура переносників дихального ланцюга.
9. Гліконеогенез
10. Пентозофосфатний шлях розпаду вуглеводів і його біологічна роль.
11.Енергетичні ефекти окислення глюкози.
ЛАБОРАТОРНЕ ЗАНЯТТЯ № 3
Не нашли, что искали? Воспользуйтесь поиском: