
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Електронні сімейства елементів
| Електронне сімейство | Положення в періодичній таблиці | Коротка електронна формула |
| s - сімейство р - сімейство d - сімейство f – сімейство | головні підгрупи I - II груп і елемент He головні підгрупи III - VIII груп (виключаючи He) побічні підгрупи I-VIII груп лантаноїди та актиноїди | n s 1-2 ns 2 np 1-6 ns 2(n – 1) d 1-10 ns 2(n – 1) d 1(n -2) f 1-14 |
Щоб скласти скорочену електронну формулу елемента, виходячи з узагальненої формули сімейства, необхідно:
- визначити, до якого сімейства відноситься елемент і взяти відповідну узагальнену формулу;
- підставити в цю формулу значення n, що дорівнює номеру періоду, у якому розташований елемент;
- визначити кількість електронів на заповнюваному підрівні, відрахувавши від першого елемента сімейства у даному періоді і підставити цю кількість у формулу.
Для наочності розподіл електронів на підрівнях показують за допомогою графічних схем валентних орбіталей. Вони використовуються наряду з короткими електронними формулами.
Приклад 4. Напишіть короткі електронні формули і побудуйте графічні схеми валентних орбіталей зазначених атомів: Са, Ni, Se, Sm.
Розв’язання. Са – другий від початку IV періоду елемент s -сімейства:

Ni – восьмий, відраховуючи від Sc, d -элемент IV періоду:
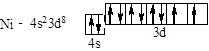
Se – четвертий, відраховуючи від Ga, p -элемент IV періоду:
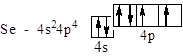
Sm – п¢ятий від Ce у ряду лантаноїдів – f -элементів VI періоду:
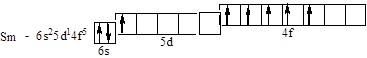
На електронну структуру деяких атомів впливає симетрія електронного розподілу. Наприклад, електронну формулу атома хрому – четвертого, відраховуючи від скандію Sc, у сімействі d -елементів IV періоду – за викладеними правилами варто записати так: 4 s 23 d 4. Однак, реалізується конфігурація з заповненими по одному електрону п'ятьма d - орбіталями, що має більш симетричний розподіл електронного заряду (і тому – меншу енергію): 4 s 13 d 5. З цієї ж причини електронна конфігурація міді в основному стані не 4 s 23 d 9, а 4 s 13 d 10. Така ситуація одержала назву "провал електрона" (з n на (n -1) рівень). Найбільшій симетрії відповідають цілком або наполовину заповнені підрівні (p 3 і p 6, d 5 і d 10, f 7 і f 14). У атома паладія Pd з 5 s -підрівня "провалюються" обидва електрони: 4 s 24 p 65 s 24 d 8 ® 4 s 24 p 64 d 10. Тому паладій – єдиний елемент періодичної системи, у якого головне квантове число електронів зовнішньої оболонки не збігається з номером періоду.
Будьте уважні при роботі з елементами d - і f - сімейств. Якщо вам потрібна точна електронна формула, звіряйтеся зі спеціальними таблицями електронних конфігурацій.
Варто пам'ятати, що всі розглянуті електронні формули відносяться до атомів, що знаходяться в стаціонарному (незбудженому) стані. Однак за певних умов може відбуватися розпаровування електронних пар при переході атомів у збуджений стан, внаслідок чого кількість неспарених електронів зростає. При цьому електрони переходять (промотуються) на вільну орбіталь розташованого вище по енергії підрівня в межах того ж енергетичного рівня.
Приклад 5. Складіть короткі електронні формули і графічні схеми атома хлору в основному (стаціонарному) і збудженому станах.
Розв’язання. Складаємо електронну формулу і схему електронної структури атома хлору в основному стані:

Cl – 3 s 23 p 5
У збудженому стані (позначається символом * ) спарені 3 s і 3 p електрони можуть роз'єднуватися, переходячи на вільні орбіталі підрівня 3 d:
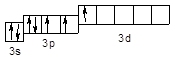
Cl* – 3 s 23 p 43 d 1
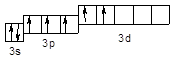
Cl** – 3 s 23 p 33 d 2
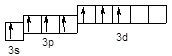
Cl*** – 3 s 13 p 33 d 3
Зверніть увагу, що атом хлору може існувати у трьох збуджених станах. Чи можлива наявність збудженого стану у атома фтору? Поясність вашу відповідь.
Навчившись писати короткі електронні формули атомів елементів, неважко складати електронні формули іонів, що відповідають існуванню елементів у різних ступенях окиснення. Для цього спочатку складають короткі електронні формули нейтральних атомів, а потім добавляють до неї (при утворенні аніонів) або видаляють (при утворенні катіонів) відповідну кількість електронів.
Приклад 6. Складіть електронні формули іонів і елементів у різних ступенях окиснення: S2- , S+2 , S+4 , S+6.
Розв’язання. Спочатку складаємо коротку електронну формулу і графічну схему атома S:

S0 3 s 23 p 4
Для одержання іона S2- до S0 необхідно додати два електрона:

S2- 3 s 23 p 6
Щоб перейти від S0 до станів S+2, S+4, S+6 необхідно видалити з нейтрального атома сірки два, чотири або шість електронів відповідно.

S+2 3 s 23 p 2

S+4 3 s 2 3 p 0
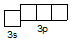
S+6 2 s 22 p 63 s 03 p 0
ДОМАШНЄ ЗАВДАННЯ
1. Який елемент має в атомі п'ять електронів, для кожного з яких n =3 і l =2? Чому дорівнюють для них значення m l? Чи повинні вони мати антипаралельні спіни?
2. Який елемент має чотири електрони, для кожного з яких
n = 4 і l = 1? Чому дорівнюють для них значення ml? Скільки електронів мають антипаралельні спіни?
3. Укажіть значення квантових чисел n, l і ml для валентних електронів в атомах елементів з порядковими номерами 19, 23, 27, 30, 33 і 36. Для визначення значень ml виходьте з припущення, що орбіталі кожного підрівня заповнюються в порядку збільшення ml, починаючи з його найбільш негативного значення.
4. Скільки електронних шарів і яке число електронів містить атом з валентною оболонкою: а) 4 s 24 p 5; б) 4 s 23 d 5; в) 5 s 25 p 3?
5. В атомі деякого елемента є п'ять електронних шарів і 6 валентних електронів. Якими квантовими числами вони характеризуються?
6. Які з приведених електронних конфігурацій неможливі і чому: 3 s 23 p 5, 3 s 22 d 6, 4 s 24 p 7, 2 s 32 p 3, 5 s 24 d 8, 4 s 23 d 12, 3 s 23 p 2, 5 s 23 f 15, 6 s 24 f 5, 2 s 12 p 3, 4 s 13 d 10, 4 s 23 d 54 p 1?
7. Яку з вільних атомних орбіталей (АО) заповнить черговий електрон відповідно до правил Клечковського: а) 4 d - чи 5s -; б) 5 p - чи 4 d -; в) 5 f - чи 4 d -; г) 5 p - чи 6 s -; д) 5 f - чи 6 s -?
8. Для скількох АО сума (n + l) = 8? Чи заповнені такі орбіталі в незбуджених атомах елементів періодичної системи? Атоми яких елементів мають найбільше значення суми (n + l)?
9. Скільки електронних шарів мають атоми елементів з порядковими номерами 8, 10, 18, 35, 39, 56, 80, 86? Скільки з них заповнені цілком і скільки частково? Спробуйте вирішити цю задачу без допомоги таблиці Менделєєва.
10. Визначте сумарний спін валентних електронів в атомах елементів з порядковими номерами 19, 20, 22, 25, 27, 30, 33, 36. Спробуйте вирішити цю задачу без допомоги таблиці Менделєєва.
У задачах 11-20 напишіть скорочені електронні формули і побудуйте графічні схеми валентних орбіталей зазначених елементів у різних ступенях окиснення.
11. Ca, Cr, Se, Se-2, Se+6
12. Ge, Zr, Rb, Rb+, Br-
13. Sr, Nb, Sb, Al+3, F-
14. Cs, Ta, B, B+3 , Br+5
15. C, Ti, He, Ti+3, Ti+4
16. W, Sb, Ra, Cl-, Cl+5
17. Na, Zn, As, Mn+2, Mn+4
18. Au, Mg, Pb, Pb+2, Pb+4
19. K, Cu, P, Cu+, Cu+2
20. Br, V, Be, Be+2, H-
ПЕРІОДИЧНИЙ ЗАКОН
Мета вивчення теми:
- глибоко зрозуміти сутність періодичного закону Д.І.Менделєєва і його обумовленість закономірностями електронної структури атомів;
- знаходити по електронній формулі атома його положення в періодичній системі: період, групу, підгрупу, сімейство і навпаки;
- виявити характер зміни по періодах і групах періодичної системи найважливіших властивостей хімічних елементів і їх сполук: енергії іонізації, спорідненості до електрона, електронегативності, ступенів окиснення, металічних і неметалічних властивостей, кислотно-основних характеристик оксидів і гидроксидів;
- по положенню в Періодичній системі давати коротку характеристику хімічних властивостей елемента і його сполук.
Періодичність зміни властивостей хімічних елементів обумовлена періодичною повторюваністю будови зовнішніх, валентних оболонок при послідовному заповненні електронами енергетичних рівнів і підрівнів атома.
Уважно обміркуйте і дайте відповіді на наступні питання: як сформулював періодичний закон Д.І.Менделєєв? У чому принципова відмінність сучасного формулювання закону? Чи завжди зростання порядкового номера елемента відповідає збільшенню його атомної маси? Яка характеристика атома однозначно визначає порядковий номер елемента?
Періодична система елементів є графічним відображенням періодичного закону. У найбільш розповсюдженій – короткій формі таблиці Д.І.Менделєєва усі відомі на цей час елементи підрозділяються на сім горизонтальних періодів і вісім вертикальних груп. Елементи великих періодів (починаючи з четвертого) поділяються крім того на два горизонтальних ряди. У кожній групі елементи великих періодів підрозділяються на дві підгрупи: головну (А) і побічну (В). До головних підгруп входять елементи малих (I–Ш) періодів (типові елементи) і подібні до них елементи великих (IV-VII) періодів. Побічні підгрупи складаються із елементів тільки великих періодів.
Особливу увагу приділіть закономірностям взаємозв'язку положення елемента в періодичній системі і будови їх атомів (табл.1). Добийтеся повного розуміння всіх
сторін цього взаємозв'язку.
По скороченій електронній формулі елемента можна визначити його положення в періодичній системі і дати коротку характеристику властивостей елемента.
Номер періоду визначається за максимальним значенням головного квантового числа (табл.1).
Сімейство елемента визначається по підрівню, що заповнюється.
Підгрупа визначається по електронному сімейству (табл.1)
Номер групи для більшості елементів дорівнює сумі електронів на валентній оболонці.
Таблиця 1
Положення елементів у періодичній системі і
електронна структура атома
| Положення в періодичній Cистемі | Фізичний зміст |
| 1.Порядковий номер елемента Z. 2. Номер періоду 3.Номер групи N гр 4.Підгрупи: а) головні (А) б) побічні (В) | Заряд ядра, число протонів, загальна кількість електронів атома. Головне квантове число n електронів зовнішньої оболонки, число енергетичних рівнів атома Загальне число валентних електронів Усі s - та p -елементи Усі d - та f -елементи |
Приклад 1. Визначте положення у періодичній системі елемента, якщо його скорочена електронна формула має вигляд: 4 s 23 d 3.
Розв’язання. Елемент знаходиться в IV періоді, тому що максимальне значення головного квантового числа дорівнює чотирьом.
Елемент відноситься до d -сімейства, тому що у нього заповнюється 3 d -підрівень. Елемент знаходиться в побічній підгрупі, тому що належить до d -сімейства (табл.1).
Елемент знаходиться у п'ятій групі, що випливає з загальної кількості валентних електронів (2+3).
Знаючи положення елемента в періодичній таблиці, знаходимо, що це ванадій V.
Періодичність електронних конфігурацій атомів зумовлює періодичність властивостей хімічних елементів і приводить до появи аналогій у системі елементів.
В групах періодичної системи об¢єднуються елементи з однаковою загальною кількістю валентних електронів. Проте, елементи мають більшу подібність між собою в межах однієї підгрупи. Вона зумовлена не тільки однаковим числом валентних електронів, але й однаковим типом валентних орбіталей. Такі елементи являються електронними аналогами. Саме за цією ознакою групи елементів поділяють на головну А і побічну В підгрупи.
Приклад 2. На підставі електронних формул елементів VII групи поясніть, чому галогени (F, Cl, Br, I) і елементи Mn, Tc, Re складають різні підгрупи цієї групи періодичної системи.
Розв’язання. Розмістимо елементи VII групи як у таблиці Д.І.Менделєєва з приведенням скорочених електронних формул:
| VII В | VII А |
| Mn - [Ar]3 d 54 s 2 ½ Tc - [Kr]4 d 55 s 2 ½ Re -[Xe]4 f 145 d 56 s 2 | F - [He]2 s 22 p 5 ½ Cl - [Ne]3 s 23 p 5 ½ Br - [Ar]3 d 104 s 24 p 5 ½ I - [Kr]4 d 105 s 25 p 5 |
З формул видно, що в атомах усіх розглянутих елементів однакова кількість валентних електронів 2 + 5 = 7. Це пояснює їх об'єднання в одній VII групі. У підгрупах об¢єднані елементи з однотипними зовнішніми електронними конфігураціями: VII А – ns 2 np 5; VII В – ns 2(n -1) d 5. У елементів різних підгруп VII групи сім валентних електронів по різному розподіляються по підрівнях. Тому властивості їх сполук сильно розрізняються при низьких і схожі при вищих ступенях окиснення.
Якщо властивості хімічних елементів перебувають у періодичній залежності від протонного числа (заряду ядра) їх атомів, то у такій самій залежності повинні перебувати й властивості їх простих та складних речовин.
При вивченні даної теми важливо звернути увагу на закономірності зміни наступних характеристик:
- валентні стани (ступені окиснення) елементів;
- атомні і іонні радіуси, енергії іонізації, спорідненості до електрона, електронегативність;
- металічні і неметалічні властивості;
- кислотно-основні властивості оксидів і гідроксидів.
Валентність і ступінь окиснення хімічних елементів є одними з найважливіших властивостей. Навчіться визначати їх, користуючись таблицею Менделєєва. Постійний у сполуках позитивний ступінь окиснення (СО), що дорівнює номеру групи, виявляють елементи, що знаходяться в лівій частині таблиці: s -елементи підгруп ІА (лужні) і ІІА (лужно-земельні), р -елементи В і Al (IIIA), d -елементи підгруп IIIB і IIB (в цих підгрупах починається і закінчується ряд d –елементів у кожному із великих періодів). Постійний СО рівний -1 у сполуках має також найбільш електронегативний із всіх елементів – фтор. Всі інші елементи виявляють перемінний ступінь окиснення.
Вищий ступінь окиснення (ВСО) елементів позитивний і збігається з номером групи. Виключення: О, F, Ar, Ne, He,
тріади підгрупи VIIIB (в тріадах ВСО досягає величини номера групи тільки у Os і Ru) і d -елементи підгрупи міді (IB), у яких ВСО дорівнює +3, тобто більше номера групи.
Не нашли, что искали? Воспользуйтесь поиском: