
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Константа равновесия
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Например, разложение нитрата аммония:
NH4NO3 ® 2H2O + N2O.
Обратимая реакция может протекать как в прямом, так и в обратном направлении. Примером обратимой реакции может служить синтез иодоводорода:
H2(г) + I2(г)  2HI(г).
2HI(г).
В начале, при смешении исходных веществ, скорость прямой реакции велика, а обратной – равна нулю. Согласно закону действия масс выражение для скорости прямой реакции запишется следующим образом:
 |  |

Исходные вещества в процессе реакции будут расходоваться, следовательно скорость прямой реакции будет уменьшаться. Одновременно появятся продукты реакции, их концентрация будет возрастать. Начнет идти обратная реакция, скорость которой будет увеличиваться:



Когда скорости прямой и обратной реакций станут одинаковыми, наступит химическое равновесие.






 ;
; 
 =
=  или
или 
Отношение констант скоростей прямой и обратной реакции тоже представляет собой константу. Она называется константой равновесия данной реакции – K.
 |

 K =
K =  .
.
Отсюда окончательно:

Концентрации, приведенные в правой части этого выражения, называются равновесными концентрациями. Константа равновесия при постоянной температуре представляет собой постоянную величину.
Если записать обратимую реакцию в общем виде:
aA + bB  cC + dD,
cC + dD,
то константа равновесия выразится уравнением:
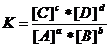 .
.
Если все компоненты реакции находятся в газообразном состоянии,то выражение константы равновесия можно записать через парциальные давления:
 .
.
Уравнения константы равновесия показывают, что в данных условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Разобранные примеры являются примерами гомогенного равновесия. В качестве примера гетерогенного равновесия рассмотрим реакцию разложения известняка:
 CaCO3(т)
CaCO3(т)  CaO(т) + CO2(г).
CaO(т) + CO2(г).
Простейшее выражение для константы равновесия этой реакции:
 .
.
До тех пор пока твердые известняк и негашеная известь находятся в контакте с газом, их влияние на равновесие не изменится. Следовательно, члены CaCO3 и CaO в выражении для константы равновесия остаются постоянными и могут быть включены в K. При этом получается новое выражение:
 ;
;  .
.
Рассмотрим еще один пример – испарение воды:
H2O(ж)  H2O(г).
H2O(г).
Этот процесс может формально рассматриваться как химическая реакция. Запишем выражение константы равновесия:
 .
.
Поскольку [ 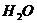 (ж)] – постоянная величина (до тех пор пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом получается выражение:
(ж)] – постоянная величина (до тех пор пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом получается выражение:
 ;
;  .
.
С практической точки зрения все сказанное выше означает, что концентрации чистых жидкостей и твердых веществ просто исключаются из выражений констант равновесия. (Однако они входят в нее неявным образом).
Принцип Ле-Шателье
Влияние изменения условий на положение равновесия определяется правилом, которое получило название принципа Ле Шателье.
Если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Система перейдет из одного состояния равновесия в другое, отвечающее новым условиям. Это происходит потому, что внешнее воздействие в разной степени изменяет скорость двух взаимнопротивоположных реакций.
Принцип Ле Шателье справедлив и для равновесных систем, не связанных с химическими превращениями (кипение, кристаллизация, равновесие и т.д.).
Не нашли, что искали? Воспользуйтесь поиском: