
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Контрольные задания. 271. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами NaHCO3иNaOH; К2SiO3иНСl;ВаСl2и Na2SO4.
271. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами NaHCO3иNaOH; К2SiO3иНСl; ВаСl2и Na2SO4.
272. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами К2S и НСl; FeSO4и (NH4)2S; Cr(OH)3 и КОН.
273. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
a)Zn2+ + H2S = ZnS + 2H+;
б) Мg2+ + CO32- = MgCO3;
в)H+ + OH- = H2O.
274. К каждому из веществ: Аl(ОН)3; Н2SО4; Ва(ОН)2 прибавили раствор едкого калия. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
275. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Pb(NO3)2 и KI; б) NiCl2 и H2S; в) K2CO3 и HCl.
276. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и NaOH; б) CaCO3 и HNO3; в) Na2SO3 и H2SO4.
277. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Fe(OH)3 и HCl; б) Ca(OH)2 и HNO3; в) NH4Cl и KOH.
278. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
a) NO  + H+ = HNO2;
+ H+ = HNO2;
б) Cu2+ + 2OH- = Cu(OH)2;
в) Zn2+ + S2- = ZnS.
279. Какие из веществ: Na2CO3; HNO3; Al(OH)3; KOH – взаимодействует с раствором соляной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
280. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CaCl2 и Na3PO4; б) Zn(NO3)2 и KOH; в) AlBr3 и AgNO3.
281. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
a) CO  + 2H+ = CO2↑ + H2O;
+ 2H+ = CO2↑ + H2O;
б) Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
282. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
a) Ag+ + Cl- = AgCl↓;
б) Al(OH)3 + 3H+ = Al3+ + 3H2O;
в) H+ + OH- = H2O.
283. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Pb(CH3COO)2 и Na2S; б) Ca(OH)2 и CO2; в) K2CO3 и HCl.
284. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) СH3COOH и NaОН; б) Zn(OH)2 и HNO3; в) AgNO3 и NaI.
285. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами КНСО3 и Н2SО4; Zn(OH)2 и NaOH; СаСl2 и АgNO3.
286. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами CuSO4 и Н2S; ВаСО3 и НNO3; FeCl3 и КОН.
287. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
а) Cu2+ + S2- = CuS;
б) Pb(OH)2 + 2OH- = PbO 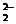 + 2H2O;
+ 2H2O;
в) SiO  + 2H+ = H2SiO3.
+ 2H+ = H2SiO3.
288. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Sn(OH)2 и НСl; ВеSO4 и КОН; NH4Cl и Ва(ОН)2.
289. К каждому из веществ: КНСО3, СН3СООН, NiSO4, Na2S прибавили раствор серной кислоты. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
290. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Hg(NO3)2 и NaI; Pb(NO3)2 и КI; CdSO4 и Na2S.
291. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2;
б) Аl(OH)3 + OH- = AlO  + 2H2O;
+ 2H2O;
в) Pb2+ + 2I- = PbI2.
292. Составьте молекулярные и ионные уравнения реакций растворения дигидроксида бериллия в растворе едкого натра; дигидроксида меди в растворе азотной кислоты.
293. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Na3PO4 и СаСl2; К2СО3 и ВаСl2; Zn(OH)2 и КОН.
294. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями
а) Zn2+ + Н2S = ZnS↓ + 2Н+;
б) Сd2+ + 2ОН- = Сd(OH)2↓;
в) Н+ + NO  = НNO2.
= НNO2.
295. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами СdS и HСl; Сr(OH)3 и NaOH; Ва(ОН)2 и СоСl2.
296. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями
а)Fe(OH)3↓+ 3H+ = Fe3+ + 3H2O;
б) HCO 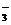 + H+ = H2O + CO2↑;
+ H+ = H2O + CO2↑;
в) Ag+ + Cl- = AgCl↓.
297. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами H2SO4 и Ba(OH)2; FeCl3 и NH4OH; CH3COOH и HCl.
298. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами FeCl3 и КОН; NiSO4 и (NH4)2S; MgCO3 и HNO3.
299. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
а)Be(OH)2 + 2OH- = BeO 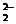 + 2H2O;
+ 2H2O;
б) CH3COO- + H+ = CH3COOH;
в) Ва2+ + SO  = BaSO4↓.
= BaSO4↓.
300. К каждому из веществ: NaCl, NiSO4, Be(OH)2, КНСО3 прибавили раствор гидроксида натрия. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
ГИДРОЛИЗ СОЛЯМИ
Под гидролизом понимают реакцию разложения молекул воды солями (от греческих слов: «гидро» – вода, «лизис» – разложение). В большинстве случаев реакция гидролиза имеет обратимый характер и приводит к изменению pH. Разлагать (гидролизовать) молекулу воды может только тот из двух ионов соли, который является остатком слабого электролита.
К слабым электролитам относятся все нерастворимые основания (Cu(OH)2, Zn(OH)2, Fe(OH)3 и т.д.), одно растворимое основание (NH4OH), некоторые неорганические кислоты (HF, H2SO3, H2S, HNO2, H3PO4, H3PO3, HCN), почти все органические кислоты и основания.
К сильным электролитам принадлежат все растворимые в воде соли, основания-щелочи (NaOH, KOH, Ca(OH)2, Ba(OH)2 и т.д.), некоторые неорганические кислоты (HCl, HBr, HI, H2SO4, HNO3).
Соли, образованные сильным основанием и сильной кислотой (NaCl, K2SO4, Ca(NO3)2 и т.д.), не гидролизуют воду. В растворах таких солей среда нейтральная (рН=7).
Гидролиз протекает в трех случаях: если соль образована слабым основанием и сильной кислотой, сильным основанием и слабой кислотой, слабым основанием и слабой кислотой.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) КСN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение.
А. Цианид калия КСN – соль слабой одноосновной кислоты НСN и сильного основания КОН. При растворении в воде молекулы КСN полностью диссоциируют на катионы К+ и анионы СN-
КСN ↔ К+ + СN-.
Катионы К+ не могут связывать ионы ОН- воды, так как КОН – сильный электролит. Анионы же СN- связывают ионы Н+ воды, образуя молекулы слабого электролита НСN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
СN-+НОН  НСN+ОН-,
НСN+ОН-,
или в молекулярной форме
КСN+Н2О 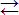 НСN+КОН.
НСN+КОН.
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор КСN имеет щелочную реакцию (рН>7).
Б. Карбонат натрия Na2CO3 – соль слабой двуосновной кислоты Н2СО3 и сильного основания NaOH. При растворении в воде молекулы Na2CO3 полностью диссоциируют на катионы Na+ и анионы CO  :
:
Na2CO3 ↔ 2Na+ + CO  .
.
В этом случае анионы соли CO  , связывая водородные ионы воды, образуют анионы кислой соли HCO
, связывая водородные ионы воды, образуют анионы кислой соли HCO 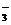 , а не молекулы Н2СО3, так как ионы HCO
, а не молекулы Н2СО3, так как ионы HCO 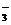 диссоциируют гораздо труднее, чем молекулы Н2СО3. В стандартных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону.
диссоциируют гораздо труднее, чем молекулы Н2СО3. В стандартных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону.
Ионно-молекулярное уравнение гидролиза
CO  + НОН
+ НОН  HCO
HCO 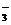 + ОН-,
+ ОН-,
или в молекулярной форме
Na2СО3+Н2О 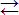 NaHCO3+NaOH.
NaHCO3+NaOH.
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
В. Сульфат цинка ZnSO4 – соль слабого двукислотного основания Zn(OH)2 и сильной кислоты Н2SO4.
ZnSO4 ↔ Zn2+ + SO  .
.
В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
Zn2++НОН 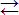 ZnOH++H+
ZnOH++H+
или в молекулярной форме
2ZnSO4+2Н2О 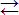 (ZnOH)2SO4+Н2SO4.
(ZnOH)2SO4+Н2SO4.
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение.
Соль Al(NO3)3 гидролизуется по катиону, а Na2СО3 – по аниону:
Al3++НОН 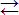 AlОН2+ + Н+;
AlОН2+ + Н+;
CO  + НОН
+ НОН 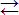 HCO
HCO 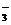 + ОН-.
+ ОН-.
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием Al(OH)3↓ и СО2↑ (Н2СО3).
Ионно-молекулярное уравнение
2Al3+ + 3CO  + 3НОН = 2Al(OH)3↓+ 3CO2↑,
+ 3НОН = 2Al(OH)3↓+ 3CO2↑,
молекулярное уравнение
2Al(NO3)3 +3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaNO3.
Не нашли, что искали? Воспользуйтесь поиском: