
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Закон эквивалентов. Открыт И. Рихтером в период 1792–1802 гг. Вещества реагируют между собой в отношениях, пропорциональных молярным массам их эквивалентов.
В законе используется понятие эквивалент _ условные или реальные частицы вещества, в zB раз меньшие, чем соответствующие им формульные единицы.
Формульная единица вещества _ это реально существующие частицы, такие, как атомы (Н, С, О), молекулы (N2, Н2О, HСl), ионы  , или условно существующие частицы (NaCl, К2SO4) и т.д.
, или условно существующие частицы (NaCl, К2SO4) и т.д.
Число zB называют числом эквивалентности или эквивалентным числом. Это число принимает только целые, положительные значения;  Значение zB определяют по химической реакции, в которой участвует данное вещество, или по формуле вещества. В зависимости от природы вещества и реакции, в которой это вещество участвует, число эквивалентности может быть переменным.
Значение zB определяют по химической реакции, в которой участвует данное вещество, или по формуле вещества. В зависимости от природы вещества и реакции, в которой это вещество участвует, число эквивалентности может быть переменным.
Величина, обратная числу эквивалентности, называется фактором эквивалентности; fB=1/zB.
Пример 2.1. Определить число эквивалентности: 1) серной кислоты в реакциях:
1а) H2SO4 + 2NaOH = Na2SO4 + 2H2O,
1в) H2SO4 + NaOH = NaHSO4 + H2O;
2) фосфора в реакциях:
2а) 4Р + 3О2 =2Р2О3;
2в) 4Р + 5О2 =2Р2О5.
Решение. 1) В обменной реакции нейтрализации (1а) 1 формульная единица (ФЕ) серной кислоты реагирует с 2 ФЕ гидроксида натрия, следовательно, число эквивалентности серной кислоты 
В реакции (1в) 1 ФЕ серной кислоты реагирует с 1 ФЕ гидроксида натрия, следовательно, число эквивалентности серной кислоты 
2) Взаимодействие фосфора с кислородом относится к окислительно-восстановительным реакциям. В этом случае число эквивалентности равно числу электронов, принимаемых 1ФЕ окислителя, или числу электронов, отдаваемых 1ФЕ восстановителя. В реакции (2а) фосфор выступает в роли восстановителя, и имеет место процесс
Р –3е = Р3+.
Следовательно, число эквивалентности фосфора zР=3.
В реакции (2а) имеем
Р –5е = Р5+ и zР=5.
Пример 2.2. Определить число эквивалентности соединения NH4 Fe(SO4)2 (железоаммонийные квасцы) в реакции
NH4 Fe(SO4)2 + 2СаСl2= 2CaSO4 ↓+ NH4 Сl + Fe Сl3.
Решение. В обменной реакции осаждения 1 формульная единица NH4 Fe(SO4)2 реагирует с 2 формульными единицами хлорида кальция. Число эквивалентности хлорида кальция равно двум, следовательно, 1 формульная единица NH4 Fe(SO4)2 реагирует с 4 эквивалентами хлорида кальция. Отсюда следует, что число эквивалентности NH4 Fe(SO4)2 равно четырём.
Число эквивалентности может быть формально определено по формуле вещества. Для простого вещества число эквивалентности равно абсолютной величине степени окисления, проявляемой одним атомом; для бинарных соединений – абсолютной величине суммы положительных или отрицательных степеней окисления атомов, составляющих соединение; для оснований, кислот и солей – абсолютной величине суммы положительных или отрицательных зарядов ионов, образующих соединение.
Пример 2.3. Определить числа эквивалентности:1) кислорода; 2) азота; 3) оксида азота (IV); 4) гидроксида кальция; 5) серной кислоты; 6) сульфата алюминия.
Решение. 1) Кислород проявляет степень окисления (-2), следовательно, число эквивалентности атомарного кислорода (О) zO=2, а число эквивалентности молекулярного кислорода (О2) 
2) Азот может иметь степени окисления (-3, -2, 0, +1, +2, +3, +4, +5). Следовательно, атомарный азот (N) может иметь числа эквивалентности 1, 2, 3, 4, 5, а молекулярный азот (N2), соответственно, 2, 4, 6, 8, 10.
3) Формула оксида азота (IV) – NO2. Степень окисления азота составляет (+4), а атома кислорода – (-2). Абсолютная величина суммы положительных или отрицательных степеней окисления составляет число эквивалентности 
4) Гидроксид кальция Са(ОН)2 диссоциирует по урав-
нению

Абсолютная величина суммы зарядов положительного иона кальция (катиона) или двух отрицательных ионов гидроксида (анионов) равна 2. Следовательно, 
5) Серная кислота диссоциирует по уравнению

Абсолютная величина суммы зарядов двух положительных ионов водорода или отрицательного иона (сульфат-иона) равна 2. Следовательно, 
6) Сульфат алюминия Al2(SO4)3 диссоциирует по уравне
нию

Абсолютная величина суммы зарядов двух положительных ионов алюминия или трех отрицательных ионов (сульфат-ионов) равна 6. Следовательно, 
Подчеркнем, что определение числа эквивалентности по формуле носит формальный характер, т.к. не связано с конкретной химической реакцией.
Применение закона эквивалентов требует введения понятия количества вещества эквивалентов В (символ nэк(В), единица – моль) – физической величины, пропорциональной числу эквивалентов вещества В, Nэк(В):
 (2.2)
(2.2)
где NA – постоянная Авогадро.
Например: nэк(3;Н3РO4)= 1,5 моль, nэк(2;Са2+)= 2 ммоль. Цифры 3 и 2 – значения чисел эквивалентности.
Так как в одной формульной единице вещества В содержится zB эквивалентов этого вещества, то справедливо соотношение
nэк(В)=zВnB, (2.3)
где nB – количество вещества В, моль.
В расчетах на основе закона эквивалентов используется также понятие молярной массы эквивалентов вещества В ( символ Мэк(В), единица _ кг/моль или г/моль) – это отношение массы вещества В (mB) к количеству вещества эквивалентов В (nэк(В)):
 (2.4)
(2.4)
Молярная масса эквивалентов вещества В всегда в zB раз меньше молярной массы этого же вещества. Поэтому для вычислений можно использовать также следующую формулу:
 (2.5)
(2.5)
Для газообразных веществ используют также понятие молярного объема эквивалентов вещества В ( символ Vэк(В), единица _ л/моль или дм3/моль). Эта величина может быть найдена как отношение молярного объема вещества В (VB) к числу эквивалентности вещества В (zэк(В)):
 (2.6)
(2.6)
Для реакции вещества А с веществом В закон эквивалентов может быть записан следужщим образом:
 . (2.7)
. (2.7)
Если в реакцию вступают газообразные вещества, то массы и молярные массы эквивалентов в формуле (2.7) могут быть заменены на объёмы и молярные объёмы эквивалентов, разумеется, приведённые к одинаковым условиям.
Пример 2.4. Определить молярную массу эквивалентов следующих веществ: 1) Cr2O3; 2) фосфора в соединении РН3; 3) соли NaH2PO4 в реакции NaH2PO4 + 2NaOH = Na3PO4 + 2 H2O.
Решение. 1) Степень окисления атома кислорода в оксиде (Cr2O3) составляет (-2). Абсолютная величина суммы степеней окисления трех атомов кислорода – 6. Следовательно, число эквивалентности оксида равно 6. Молярная масса Cr2O3
 г/моль.
г/моль.
Таким образом, молярная масса эквивалентов Cr2O3
 г/моль.
г/моль.
2) Степень окисления атома водорода в гидриде фосфора (фосфин) РН3 составляет (+1). Абсолютная величина суммы степеней окисления трех атомов водорода составляет 3. Следовательно, степень окисления фосфора равна (-3) и число эквивалентности фосфора равно 3. Молярная масса фосфора составляет 31 г/моль, а молярная масса эквивалентов фосфора в фосфине
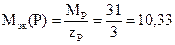 г/моль.
г/моль.
3) Одна формульная единица дигидрофосфата натрия (NaH2PO4) реагирует с двумя формульными единицами гидроксида натрия. Число эквивалентности гидроксида натрия равно 1, следовательно, число эквивалентности NaH2PO4 в данной реакции составляет 2. Таким образом, молярная масса эквивалентов NaH2PO4 будет

=(23+2.1+31+4.16)/2=60 г/моль.
Пример 2.5. Сульфид металла содержит 67,15% металла. Вычислить молярную массу эквивалентов металла, если молярная масса эквивалентов серы составляет 16 г/моль.
Решение. Из условия задачи следует, что 100 г сульфида металла содержит 67,15 г металла и 32,85 г серы. Согласно закону эквивалентов эти массы пропорциональны молярным массам эквивалентов металла и серы. Следовательно,
67,15 г металла эквивалентны 32,85 г серы,
Мэк(Ме) эквивалентна Мэк(S)=16 г/моль серы.
Откуда
 г/моль.
г/моль.
Пример 2.6. На восстановление 1 г оксида металла израсходован 421 см3 водорода (н.у.). Вычислить молярные массы эквивалентов оксида и металла.
Решение. Число эквивалентности молекулярного водорода Н2 равно двум, следовательно, молярная масса эквивалентов водорода
 г/моль.
г/моль.
В соответствии с законом Авогадро объем 1 моль водорода при н.у. составляет 22,4 л, следовательно, молярный объем эквивалентов водорода при н.у.
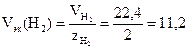 л/моль = 11200 см3/моль.
л/моль = 11200 см3/моль.
В соответствии с законом эквивалентов масса оксида и объем водорода, вступившие в реакцию, пропорциональны молярным массам (молярным объемам) их эквивалентов. Значит,
1 г оксида эквивалентен 421 см3 водорода,
Мэк(оксид) эквивалентна 11200 см3/моль водорода.
Откуда
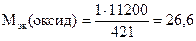 г/моль.
г/моль.
Любой оксид состоит из кислорода и другого элемента, соединенных в эквивалентных количествах. Следовательно, молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и металла, образующего оксид:
Мэк(оксид)=Мэк(металл) + Мэк(О).
Число эквивалентности кислорода zO=2, значит,
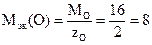 г/моль.
г/моль.
Таким образом, молярная масса эквивалентов металла, образующего оксид, составляет
Мэк(металл)= Мэк(оксид) - Мэк(О)= 26,6 – 8 =18,6 г/моль.
Пример 2.7. В реакцию с 10,0 г едкого натра вступило 22,25 г пирофосфорной кислоты (Н4Р2О7). Найти молярную массу эквивалента, число эквивалентности и основность кислоты в этой реакции.Записатьуравнение реакции.
Решение. В соответствии с законом эквивалентов массы гидроксида натрия и пирофосфорной кислоты, вступившие в реакцию, эквивалентны. Число эквивалентности гидроксида натрия постоянно и равно единице. Следовательно, молярная масса эквивалента гидроксида натрия равна его молярной массе:

На основании закона эквивалентов запишем:
22, 25 г Н4Р2О7 реагируют с 10 г NaOH,
Mэк(Н4Р2О7) - “ - 40 г NaOH,

Находим число эквивалентности пирофосфорной кислоты в данной реакции:

Число эквивалентности кислоты в реакции нейтрализации соответствует числу ионов водорода, замещённых катионами металла, т.е. основности кислоты. Следовательно, основность пирофосфорной кислоты в данном случае равна двум и уравнение реакции имеет вид
Н4Р2О7 + 2 NaOH = Na2Н2Р2О7 + 2H2O.
Не нашли, что искали? Воспользуйтесь поиском: