
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Металл, стоящий в ряду напряжений левее, " вытесняет " из раствора соли любой металл, стоящий в этом ряду правее.
Но так происходит только в том случае, если оба металла не реагируют с водой. Следовательно, магний без побочных реакций " вытеснит " любой металл, стоящий правее него в ряду напряжений, из раствора его соли, а при взаимодействии кальция с тем же раствором прежде всего будет выделяться водород (кроме того, будут протекать и другие реакции; какие?).
В качестве примера составим уравнение реакции магния с раствором нитрата свинца (заполненный шаблон – см дальше).
Напротив, если мы поместим кусочек меди в раствор нитрата цинка, то никакой реакции протекать не будет, так как медь в ряду напряжений стоит правее цинка и не может " вытеснить" его из раствора.Внимательно рассмотрев ряд напряжений, вы обнаружите в нем водород и ион оксония. Вот с чем это связано.
| Исходные вещества | Mg | Pb(NO3)2 |
| Взаимодействие их с водой | Не реагирует | Pb(NO3)2 = Pb2 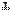 aq + 2NO3 aq + 2NO3 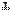 aq aq
|
| Перечень частиц, оказавшихся в растворе (и не реагирующих с водой веществ) до начала реакции | Mg, Pb2 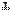 aq, NO3 aq, NO3 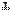 aq, H2O
(Магний в ряду напряжений стоит левее свинца, следовательно, он "активнее", чем свинец) aq, H2O
(Магний в ряду напряжений стоит левее свинца, следовательно, он "активнее", чем свинец)
| |
| Ионное уравнение | Mg + Pb2 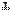 aq =Mg2 aq =Mg2 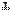 aq + Pb aq + Pb
| |
| Перечень частиц в растворе после завершения реакции | Mg2 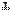 , NO3 , NO3 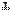 , H2O , H2O
| |
| Проверка | Эти частицы между собой не реагируют | |
| " Молекулярное" уравнение | Mg + Pb(NO3)2р = Mg(NO3)2р + Pb 
|
Задание:
1.Составьте уравнения реакций, протекающих в водном растворе между: а) CuSO4 и Zn; б) AgNO3 и Cu; в) Hg(NO3)2 и Cr; г) HCl и Al; д) H2SO4 и Ni; е) HBr и Mn.
2.С растворами каких из следующих веществ будет реагировать хром: а) AgNO3; б) NaCl; в) NiSO4; г) Cu(NO3)2; д) CaBr2; е) Al2(SO4)3?
3.Какие вещества вступили в реакцию, если в результате реакции образовались а) Ag и Pb(NO3)2p; б) H2 и MgSO4p; в) Pb и Al(NO3)3p; г) H2 и FeCl2p; д) CaCO3 и NaClp; е) Fe(OH)3 и Rb2SO4p?
4.Осуществите превращения:
а) Mg - MgSO4 - Mg(OH)2 - MgO;
б) S - SO2 - SO3 - H2SO4 - ZnSO4 - BaSO4.
Вещества
 К важнейшим классам неорганических веществ по традиции относят простые вещества (металлы и неметаллы), оксиды (кислотные, основные и амфотерные), гидроксиды (часть кислот, основания, амфотерные гидроксиды) и соли. Вещества, относящиеся к одному и тому же классу, обладают сходными химическими свойствами. Но вы уже знаете, что при выделении этих классов используют разные классификационные признаки..
К важнейшим классам неорганических веществ по традиции относят простые вещества (металлы и неметаллы), оксиды (кислотные, основные и амфотерные), гидроксиды (часть кислот, основания, амфотерные гидроксиды) и соли. Вещества, относящиеся к одному и тому же классу, обладают сходными химическими свойствами. Но вы уже знаете, что при выделении этих классов используют разные классификационные признаки..
Начнем с простых веществ (классификация по числу элементов, входящих в состав вещества). Их обычно делят на металлы и неметаллы (рис. 13.1- а).
| Металлы– простые вещества, в которых атомы связаны между собой металлической связью. |
Из этого определения видно, что главным признаком, позволяющим нам разделить простые вещества на металлы и неметаллы, является тип химической связи.
В большинстве неметаллов связь ковалентная. Но есть еще и благородные газы (простые вещества элементов VIIIA группы), атомы которых в твердом и жидком состоянии связаны только межмолекулярными связями. Отсюда и определение.
| Неметаллы– простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями. |
 По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов. Это название отражает способность этих металлов реагировать как с кислотами, так и со щелочами (как амфотерные оксиды или гидроксиды) (рис. 13.1- б).
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов. Это название отражает способность этих металлов реагировать как с кислотами, так и со щелочами (как амфотерные оксиды или гидроксиды) (рис. 13.1- б).
Кроме этого, из-за химической инертности среди металлов выделяют благородные металлы. К ним относят золото, рутений, родий, палладий, осмий, иридий, платину. По традиции к благородным металлам относят и несколько более реакционно-способное серебро, но не относят такие инертные металлы, как тантал, ниобий и некоторые другие. Есть и другие классификации металлов, например, в металлургии все металлы делят на черные и цветные, относя к черным металлам железо и его сплавы.
Из сложных веществ наибольшее значение имеют, прежде всего, оксиды, но так как в их классификации учитываются кислотно-основные свойства этих соединений, мы сначала вспомним, что такое кислоты и основания.
| Кислоты – сложные вещества, содержащие в своем составе ионы оксония или при взаимодействии с водой образующие в качестве катионов только эти ионы. Основания – сложные вещества, содержащие в своем составе гидроксид-ионы или при взаимодействии с водой образующие в качестве анионов только эти ионы. |
Таким образом, мы выделяем кислоты и основания из общей массы соединений, используя два признака: состав и химические свойства.
По составу кислоты делятся на кислородсодержащие (оксокислоты) и бескислородные (рис. 13.2).
| Кислородсодержащие кислоты (оксокислоты) – кислоты, в состав которых входят атомы кислорода. Бескислородные кислоты – кислоты, молекулы которых не содержат кислорода. |
Следует помнить, что кислородсодержащие кислоты по своему строению являются гидроксидами.
Примечание. По традиции для бескислородных кислот слово кислота" используется в тех случаях, когда речь идет о растворе соответствующего индивидуального вещества, например: вещество HCl называют хлороводородом, а его водный раствор – хлороводородной или соляной кислотой.
Теперь вернемся к оксидам. Мы относили оксиды к группе кислотных или основных по тому, как они реагируют с водой (или по тому, из кислот или из оснований они получаются). Но с водой реагируют далеко не все оксиды, зато большинство из них реагирует с кислотами или щелочами, поэтому оксиды лучше классифицировать по этому свойству.
| Основные оксиды – оксиды, способные реагировать с кислотами и не способные реагировать со щелочами. Кислотные оксиды – оксиды, способные реагировать со щелочами и не способные реагировать с кислотами. Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами. |
 Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, ни со щелочами. Такие оксиды называют несолеобразующими. Это, например, CO, SiO, N2O, NO, MnO2. В отличие от них, остальные оксиды называют солеобразующими (рис. 13.3).
Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, ни со щелочами. Такие оксиды называют несолеобразующими. Это, например, CO, SiO, N2O, NO, MnO2. В отличие от них, остальные оксиды называют солеобразующими (рис. 13.3).
 Как вы знаете, большинство кислот и оснований относится к гидроксидам. По способности гидроксидов реагировать и с кислотами, и со щелочами среди них (как и среди оксидов) выделяют амфотерные гидроксиды (рис. 13.4).
Как вы знаете, большинство кислот и оснований относится к гидроксидам. По способности гидроксидов реагировать и с кислотами, и со щелочами среди них (как и среди оксидов) выделяют амфотерные гидроксиды (рис. 13.4).
| Амфотерные гидроксиды – гидроксиды, способные реагировать и с кислотами, и со щелочами. |
Теперь нам осталось дать определение солей. Термин " соль" используется издавна. По мере развития науки, его смысл неоднократно изменялся, расширялся и уточнялся. В современном понимании соль – это ионное соединение, но традиционно к солям не относят ионные оксиды (так как их называют основными оксидами), ионные гидроксиды (основания), а также ионные гидриды, карбиды, нитриды и т. п. Поэтому упрощенно можно сказать, что
| Соли – ионные соединения, но не гидриды, не оксиды и не гидроксиды. |
Можно дать и другое, более точное, определение солей.
| Соли – ионные соединения, в состав которых в качестве анионов входят кислотные остатки. |
Давая такое определение, соли оксония обычно относят и к солям, и к кислотам.
Соли принято подразделять по составу на кислые, средние и основные (рис. 13.5).
| Кислые соли – соли, в состав которых входят анионы, способные отдавать протон. |
То есть в состав анионов кислых солей входят атомы водорода, связанные ковалентными связями с другими атомами анионов и способные отрываться под действием оснований.
| Основные соли– соли, в состав которых входят катионы, способные принимать протон и содержащие гидроксильные группы (группы – О– Н). |
Основные соли обычно имеют очень сложный состав и часто нерастворимы в воде. Типичный пример основной соли – минерал малахит Cu2(OH)2CO3.
 Как видите, важнейшие классы химических веществ выделяются по разным классификационным признакам. Но по какому бы признаку мы не выделяли класс веществ, все вещества этого класса обладают общими химическими свойствами.
Как видите, важнейшие классы химических веществ выделяются по разным классификационным признакам. Но по какому бы признаку мы не выделяли класс веществ, все вещества этого класса обладают общими химическими свойствами.
Задание:
1.Напишите формулы пяти металлов и пяти неметаллов.
2.Каким оксидам соответствуют следующие гидроксиды:
H2SO4, Ca(OH)2, H3PO4, Al(OH)3, HNO3, LiOH?
Каков характер (кислотный или основный) каждого из этих оксидов?
3.Среди следующих веществ найдите соли. Составьте их структурные формулы.
KNO2, Al2O3, Al2S3, HCN, CS2, H2S, K2[Zn(OH)4], SiCl4, CaSO4, AlPO4
Металлы
В кристаллах металлов и в их расплавах атомные остовы связывает единое электронное облако металлической связи. Как и отдельный атом элемента, образующего металл, кристалл металла обладает способностью отдавать электроны. Склонность металла отдавать электроны зависит от его строения и, прежде всего, от размера атомов: чем больше атомные остовы (то есть чем больше ионные радиусы), тем легче металл отдает электроны.
Металлы – простые вещества, поэтому степень окисления атомов в них равна 0. Вступая в реакции, металлы почти всегда изменяют степень окисления своих атомов. Атомы металлов, не обладая склонностью принимать электроны, могут только их отдавать или обобществлять. Электроотрицательность этих атомов невелика, поэтому даже при образовании ими ковалентных связей атомы металлов приобретают положительную степень окисления. Следовательно, все металлы в той или иной степени проявляют восстановительные свойства. Они реагируют:
1) С неметаллами (но не все и не со всеми):
4Li + O2 = 2Li2O,
3Mg + N2 = Mg3N2 (при нагревании),
Fe + S = FeS (при нагревании).
Наиболее активные металлы легко реагируют с галогенами и кислородом, а с очень прочными молекулами азота реагирует только литий и магний.
Реагируя с кислородом, большинство металлов образует оксиды, а наиболее активные – пероксиды (Na2O2, BaO2) и другие более сложные соединения.
2) С оксидами менее активных металлов:
2Ca + MnO2 = 2CaO + Mn (при нагревании),
2Al + Fe2O3 = Al2O3 + 2Fe (с предварительным нагреванием).
Возможность протекания этих реакций определяется общим правилом (ОВР протекают в направлении образования более слабых окислителя и восстановителя) и зависит не только от активности металла (более активный, то есть легче отдающий свои электроны металл восстанавливает менее активный), но и от энергии кристаллической решетки оксида (реакция протекает в направлении образования более " прочного" оксида).
3) С растворами кислот:
Mg + 2H3O+ = Mg2+ + H2 + 2H2O, Fe + 2H3O+ = Fe2+ + H2 + 2H2O,
Mg + H2SO4p = MgSO4p + H2, Fe + 2HClp = FeCl2p + H2.
В этом случае возможность реакции легко определяется по ряду напряжений (реакция протекает, если металл в ряду напряжений стоит левее водорода).
4) C растворами солей:
Fe + Cu2+ = Fe2+ + Cu, Cu + 2Ag+ = Cu2+ +2Ag,
Fe + CuSO4p = Cu + FeSO4p, Cu + 2AgNO3p = 2Ag + Cu(NO3)2p.
Для определения возможности протекания реакции здесь также используется ряд напряжений.
5) Кроме этого, наиболее активные металлы (щелочные и щелочноземельные) реагируют с водой:
2Na + 2H2O = 2Na+ + H2 + 2OH-, Ca + 2H2O = Ca2+ + H2 + 2OH-,
2Na + 2H2O = 2NaOHp + H2, Ca + 2H2O = Ca(OH)2p + H2.
Во второй реакции возможно образование осадка Ca(OH)2.
Большинство металлов в промышленности получают, восстанавливая их оксиды:
Fe2O3 + 3CO = 2Fe + 3CO2 (при высокой температуре),
MnO2 + 2C = Mn + 2CO (при высокой температуре).
В лаборатории для этого часто используют водород:

Задание:
1.Осуществите превращения
а) Li - Li2O - LiOH - LiCl; б) NaCl - Na - Na2O2;
в) FeO - Fe - FeS - Fe2O3; г) CuCl2 - Cu(OH)2 - CuO - Cu - CuBr2.
2.Восстановите левые части уравнений:
а)... = H2O + Cu;
б)... = 3CO + 2Fe;
в)... = 2Cr + Al2O3
Неметаллы
В отличие от металлов, неметаллы очень сильно отличаются друг от друга по своим свойствам – как физическим, так и химическим, и даже по типу строения. Но, не считая благородных газов, во всех неметаллах связь между атомами ковалентная.
Атомы, входящие в состав неметаллов, обладают склонностью к присоединению электронов, но, образуя простые вещества, " удовлетворить" эту склонность не могут. Поэтому неметаллы (в той или иной степени) обладают склонностью присоединять электроны, то есть могут проявлять окислительные свойства. Окислительная активность неметаллов зависит, с одной стороны, от размеров атомов (чем меньше атомы, тем активнее вещество), а с другой – от прочности ковалентных связей в простом веществе (чем прочнее связи, тем менее активно вещество). При образовании ионных соединений атомы неметаллов действительно присоединяют " лишние" электроны, а при образовании соединений с ковалентными связями – лишь смещают в свою сторону общие электронные пары. И в том, и в другом случае степень окисления уменьшается.
Неметаллы могут окислять:
1) металлы (вещества более или менее склонные отдавать электроны):
3F2 + 2Al = 2AlF3,
O2 + 2Mg = 2MgO (с предварительным нагреванием),
S + Fe = FeS (при нагревании),
2C + Ca = CaC2 (при нагревании).
2) другие неметаллы (менее склонные принимать электроны):
2F2 + C = CF4 (при нагревании),
O2 + S = SO2 (с предварительным нагреванием),
S + H2 = H2S (при нагревании),
3) многие сложные вещества:
4F2 + CH4 = CF4 + 4HF,
3O2 + 4NH3 = 2N2 + 6H2O (при нагревании),
Cl2 + 2HBr = Br2 + 2HCl.
Здесь возможность протекания реакции определяется прежде всего прочностью связей в реагентах и продуктах реакции и может быть определена путем расчета d G.
Самый сильный окислитель – фтор. Ненамного уступают ему кислород и хлор (обратите внимание на их положение в системе элементов).
В значительно меньшей степени окислительные свойства проявляют бор, графит (и алмаз), кремний и другие простые вещества, образованные элементами, примыкающими к границе между металлами и неметаллами. Атомы этих элементов менее склонны присоединять электроны. Именно эти вещества (особенно графит и водород) способны проявлять восстановительные свойства:
2С + MnO2 = Mn + 2CO,
4H2 + Fe3O4 = 3Fe + 4H2O.
Остальные химические свойства неметаллов вы изучите в следующих разделах при знакомстве с химией отдельных элементов (как это было в случае кислорода и водорода).
Задание:
1.Какие из приведенных веществ являются неметаллами: Be, C, Ne, Pt, Si, Sn, Se, Cs, Sc, Ar, Ra?
2.Приведите примеры неметаллов, при обычных условиях представляющих собой а) газы, б) жидкости, в) твердые вещества.
3.Приведите примеры а) молекулярных и б) немолекулярных простых веществ.
4.Осуществите превращения:
а) P4 - P4O10 - H3PO4; б) H2 - NaH - H2; в) Cl2 - NaCl - Cl2.
Основные оксиды
Вы уже знаете, что все основные оксиды – твердые немолекулярные вещества с ионной связью.
К основным оксидам относятся:
а) оксиды щелочных и щелочноземельных элементов,
б) оксиды некоторых других элементов, образующих металлы, в низших степенях окисления, например: СrO, MnO, FeO, Ag2O и др.
В их состав входят однозарядные, двухзарядные (очень редко трехзарядные катионы) и оксид-ионы. Наиболее характерные химические свойства основных оксидов как раз и связаны с присутствием в них двухзарядных оксид-ионов (очень сильных частиц-оснований). Химическая активность основных оксидов зависит прежде всего от прочности ионной связи в их кристаллах.
1) Все основные оксиды реагируют с растворами сильных кислот:
Li2O + 2H3O+ = 2Li+ + 3H2O, NiO + 2H3O+ = Ni2+ +3H2O,
Li2O + 2HClp = 2LiClp + H2O, NiO + H2SO4p = NiSO4p + H2O.
В первом случае кроме реакции с ионами оксония протекает еще и реакция с водой, но, так как ее скорость значительно меньше, ею можно пренебречь, тем более что в итоге все равно получаются те же продукты.
Возможность реакции с раствором слабой кислоты определяется как силой кислоты (чем сильнее кислота, тем она активнее), так и прочностью связи в оксиде (чем слабее связь, тем активнее оксид).
2) Оксиды щелочных и щелочноземельных металлов реагируют с водой:
Li2O + H2O = 2Li+ + 2OH- BaO + H2O = Ba2+ + 2OH-
Li2O + H2O = 2LiOHp, BaO + H2O = Ba(OH)2p.
3) Кроме того, основные оксиды реагируют с кислотными оксидами:
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
Na2O + N2O5 = 2NaNO3.
В зависимости от химической активности тех и других оксидов реакции могут протекать при обычной температуре или при нагревании.
4) Многие основные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем:
MnO + Ca = Mn + CaO (при нагревании),
FeO + H2 = Fe + H2O (при нагревании).
Возможность протекания таких реакций зависит не только от активности восстановителя, но и от прочности связей в исходном и образующемся оксиде.
Общим способом получения почти всех основных оксидов является окисление соответствующего металла кислородом. Таким способом не могут быть получены оксиды натрия, калия и некоторых других очень активных металлов (в этих условиях они образуют пероксиды и более сложные соединения), а также золота, серебра, платины и других очень малоактивных металлов (эти металлы не реагируют с кислородом). Основные оксиды могут быть получены термическим разложением соответствующих гидроксидов, а также некоторых солей (например, карбонатов). Так, оксид магния может быть получен всеми тремя способами:
2Mg + O2 = 2MgO,
Mg(OH)2 = MgO + H2O,
MgCO3 = MgO + CO2.
Задание:
1.Составьте уравнения реакций:
а) Li2O + CO2  б) Na2O + N2O5
б) Na2O + N2O5  в) CaO + SO3
в) CaO + SO3 
г) Ag2O + HNO3  д) MnO + HCl
д) MnO + HCl  е) MgO + H2SO4
е) MgO + H2SO4 
2.Составьте уравнения реакций, протекающих при осуществлении следующих превращений:
а) Mg - MgO - MgSO4 б) Na2O - Na2SO3 - NaCl
в) CoO - Co - CoCl2 г) Fe - Fe3O4 – FeO
Кислотные оксиды
Все кислотные оксиды - вещества с ковалентной связью.
К кислотным оксидам относятся:
а) оксиды элементов, образующих неметаллы,
б) некоторые оксиды элементов, образующих металлы, если металлы в этих оксидах находятся в высших степенях окисления, например, CrO3, Mn2O7.
Среди кислотных оксидов есть вещества, представляющие собой при комнатной температуре газы (например: СО2, N2O3, SO2, SeO2), жидкости (например, Mn2O7) и твердые вещества (например: B2O3, SiO2, N2O5, P4O6, P4O10, SO3, I2O5, CrO3). Большинство кислотных оксидов - молекулярные вещества (исключения составляют B2O3, SiO2, твердый SO3, CrO3 и некоторые другие; существуют и немолекулярные модификации P2O5). Но и немолекулярные кислотные оксиды при переходе в газообразное состояние становятся молекулярными.
Для кислотных оксидов характерны следующие химические свойства.
1) Все кислотные оксиды реагируют с сильными основаниями, как с твердыми:
CO2 + Ca(OH)2 = CaCO3 + H2O
SiO2 + 2KOH = K2SiO3 + H2O (при нагревании),
так и с растворами щелочей:
SO3 + 2OH- = SO42- + H2O, N2O5 + 2OH- = 2NO3- + H2O,
SO3 + 2NaOHр = Na2SO4р + H2O, N2O5 + 2KOHр = 2KNO3р + H2O.
Причина протекания реакций с твердыми гидроксидами та же, что с оксидами.
Наиболее активные кислотные оксиды (SO3, CrO3, N2O5, Cl2O7) могут реагировать и с нерастворимыми (слабыми) основаниями.
2) Кислотные оксиды реагируют с основными оксидами:
CO2 + CaO = CaCO3
P4O10 + 6FeO = 2Fe3(PO4)2 (при нагревании)
3) Многие кислотные оксиды реагируют с водой.
N2O3 + H2O = 2HNO2 SO2 + H2O = H2SO3 (более правильная запись формулы сернистой кислоты -SO2 .H2O
N2O5 + H2O = 2HNO3 SO3 + H2O = H2SO4
Многие кислотные оксиды могут быть получены путем окисления кислородом (сжигания в кислороде или на воздухе) соответствующих простых веществ (Cгр, S8, P4, Pкр, B, Se, но не N2 и не галогены):
C + O2 = CO2,
S8 + 8O2 = 8SO2,
или при разложении соответствующих кислот:
H2SO4 = SO3 + H2O (при сильном нагревании),
H2SiO3 = SiO2 + H2O (при высушивании на воздухе),
H2CO3 = CO2 + H2O (при комнатной температуре в растворе),
H2SO3 = SO2 + H2O (при комнатной температуре в растворе).
Неустойчивость угольной и сернистой кислот позволяет получать CO2 и SO2 при действии сильных кислот на карбонаты Na2CO3 + 2HClp = 2NaClp + CO2  +H2O
+H2O
(реакция протекает как в растворе, так и с твердым Na2CO3), и сульфиты
K2SO3тв + H2SO4конц = K2SO4 + SO2  + H2O (если воды много, диоксид серы в виде газа не выделяется).
+ H2O (если воды много, диоксид серы в виде газа не выделяется).
Задание:
1.Составьте уравнения реакций, протекающих при взаимодействии с раствором гидроксида натрия а) оксида углерода(IV), б) оксида серы(IV), в) оксида азота(III), г) оксида азота(V). Зависят ли продукты каждой из этих реакций от того, какое из исходных веществ взято в избытке?
2.Составьте уравнения реакций, по которым из соответствующих оксидов можно получить следующие соли: карбонат бария, фосфат натрия, сульфит магния, силикат цинка.
3.С какими из следующих оксидов может реагировать гидроксид калия: SiO2, MgO, Al2O3, FeO, SeO3, Mn2O7. Укажите условия протекания этих реакций.
Амфотерные оксиды
К амфотерным оксидам относят ZnO, Al2O3, BeO, Cr2O3, PbO, CuO и некоторые другие оксиды. Химическая связь в них плохо описывается как в рамках модели ионной связи, так и в рамках модели ковалентной связи.
По химическим свойствам амфотерные оксиды похожи на основные оксиды и отличаются от них только своей способностью реагировать с щелочами, как с твердыми (при сплавлении), так и с растворами, а также с основными оксидами. Рассмотрим эти реакции на примере оксида цинка.
При сплавлении оксида цинка со щелочью (например, NaOH) оксид цинка ведет себя как кислотный оксид, образуя в результате реакции соль - цинкат натрия:
ZnO + 2NaOH = Na2ZnO2 + H2O  .
.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2OH  + H2O = [Zn(OH)4]2
+ H2O = [Zn(OH)4]2  .
.
Молекулярное уравнение: ZnO + 2NaOHp + H2O = Na2[Zn(OH)4]p.
Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора - тетрагидроксоцинкатом натрия.
В аналогичные реакции вступают и другие амфотерные оксиды. Состав и названия этих веществ легко можно определить, пользуясь таблицей 34.
При нагревании амфотерные оксиды реагируют с основными оксидами
ZnO + Na2O = Na2ZnO2, но только в случае оксидов щелочных металлов может идти речь об образовании солей, в остальных случаях образуются сложные оксиды.
Способы получения амфотерных оксидов те же, что и основных оксидов.
Резкой границы как между амфотерными и основными, так и между амфотерными и кислотными оксидами нет. В очень жестких условиях амфотерные свойства могут проявлять как некоторые основные оксиды (например, MgO под давлением при высокой температуре и высокой концентрации щелочи), так и некоторые кислотные оксиды (например, B2O3).
Задание:
Осуществите превращения:
а) Pb(NO3)2 - Pb(OH)2 - PbO - Na2PbO2 - Pb(NO3)2,
б) Al2(SO4)3 - Al(OH)3 - Al2O3 - Na3[Al(OH)6] - AlCl3.
Основания
К основаниям относятся:
а) ионные гидроксиды, соответствующие основным оксидам;
б) некоторые не содержащие гидроксидных ионов вещества, молекулы которых способны принимать протон (аммиак NH3, гидразин N2H4 и некоторые другие соединения).
Частицами-основаниями в этих веществах являются или гидроксид-ионы (а), или сами молекулы оснований (б).
Все основания удобно разделить на три группы: I - растворимые ионные основания (щелочи), II - нерастворимые (то есть очень мало растворимые) основания и III - молекулярные основания.
Все растворимые ионные основания (щелочи) являются сильными основаниями. Из нерастворимых гидроксидов слабыми являются только те, которые в той или иной степени проявляют амфотерные свойства. Все молекулярные основания - слабые.
Основания I группы в воде химически растворяются, основания II группы также химически растворяются в воде, но крайне незначительно, а растворение оснований III группы - отчасти физическое, а отчасти химическое (часть растворившихся молекул обратимо реагирует с водой):

По той или иной причине в растворах оснований присутствуют гидроксид-ионы, поэтому растворы оснований I и III группы изменяют окраску кислотно-основных индикаторов.
Реакции, характеризующие химические свойства оснований, распадаются на две группы. К первой относятся КОР, связанные с наличием в составе оснований частиц, способных принимать протон (частиц-оснований). Это реакции с веществами, содержащими частицы-кислоты или амфолиты (см. рис. 12.1): с сильными кислотами, со слабыми кислотами (в том числе с катионными) и с кислыми солями.
1) Все основания реагируют с растворами сильных кислот, то есть с растворами, содержащими ионы оксония.
OH- + H3O+ = 2H2O, Fe(OH)2 + 2H3O+ = Fe2+ + 4H2O, NH3 + H3O+ = NH4+ + H2O,
NaOHр + HNO3р = NaNO3р + H2O, Fe(OH)2 + 2HClр = FeCl2р + 2H2O, NH3 + HClO4р = NH4ClO4р.
1а) Сильные основания реагируют и со слабыми кислотами:
OH- + HNO2 = H2O + NO2-, 2OH- + H2SiO3 = 2H2O + SiO32-,
KOHp + HNO2p = H2O + KNO2p, 2KOHp + H2SiO3 = 2H2O + K2SiO3p.
Возможность реакции слабого основания со слабой кислотой определяется общим правилом, определяющим направление протекания КОР.
Кислотно-основные реакции между веществами-основаниями и веществами-кислотами могут протекать и в отсутствие воды:
KOHкр + H3PO4ж = KH2PO4кр + H2O; Mg(OH)2кр + 2HClг = MgCl2кр + 2H2O; NH3г + HClг = NH4Clкр.
Правда, практическое значение эти реакции имеют только для оснований III группы, так как в остальных случаях вода образуется сразу после начала реакции.
2) Растворимые основания реагируют с растворами кислых солей, содержащими как анионы-амфолиты, так и гидросульфат-ион и подобные ему частицы-кислоты:
OH- + HCO3- = H2O + CO32-, NH3 + HSO4- = NH4+ + SO42-,
NaOHр + NaHCO3р = H2O + Na2CO3р; 2NH3 + 2NaHSO4р = Na2SO4p + (NH4)2SO4p.
Гидросульфаты, кроме того, реагируют и с нерастворимыми основаниями.
3) Растворимые основания реагируют с растворами солей, в состав которых входят катионные кислоты:
2OH- + Fe2+ aq = Fe(OH)2 aq 
|
2NaOHp + FeSO4p = Fe(OH)2  + Na2SO4p + Na2SO4p
|
2NH3 + 2H2O + Mg2+ aq = Mg(OH)2 aq  + 2NH4+ + 2NH4+
|
2NH3 + 2H2O + MgSO4 aq = Mg(OH)2  + (NH4)2SO4p + (NH4)2SO4p
|
Упрощенно эти реакции можно рассматривать как реакции осаждения из растворов нерастворимых гидроксидов.
Растворы щелочей реагируют с растворами солей, в состав которых входят катионные кислоты и другого типа, иными словами, в том случае, когда при реакции образуется растворимое слабое основание:
OH- + NH4+ = H2O + NH3, 2KOH + (NH4)2SO4 = K2SO4 + 2NH3 + 2H2O.
В приведенной реакции из концентрированных растворов или при нагревании аммиак может выделяться в виде газа. Выделение аммиака происходит полнее, если концентрированным раствором щелочи обработать твердый сульфат аммония.
Ко второй группе реакций относятся реакции, не являющиеся кислотно-основными и вызванные стремлением к делокализации заряда. Это реакции с кислотными и амфотерными оксидами, а также с амфотерными гидроксидами.
4) Щелочи (и малорастворимые основания) реагируют с кислотными и амфотерными оксидами, при этом в реакции могут вступать, как твердые щелочи (или расплавы)
2KOH + SO3 = K2SO4 + H2O, 2NaOH + Cr2O3 = 2NaCrO2 + H2O (при нагревании),
так и их растворы
2OH- + CO2 = CO32+ + H2O, 2OH- + ZnO + H2O = [Zn(OH)4]2-,
2NaOH + CO2 = Na2CO3 + H2O, 2KOH + ZnO + H2O = K2[Zn(OH)4].
Диоксид кремния с заметной скоростью реагирует только с расплавами щелочей:
SiO2кр + 2NaOHж = Na2SiO3 + H2O (при нагревании).
5) Щелочи реагируют с амфотерными гидроксидами:
2OH- + Zn(OH)2 = [Zn(OH)4]2-, 3OH- + Cr(OH)3 = [Cr(OH)6]3-,
2NaOHр + Zn(OH)2 = Na2[Zn(OH)4]р, 3KOHр + Cr(OH)3 = K3[Cr(OH)6]р.
В случае, когда гидроксид гидратирован (свежеосажденный и не высушенный), эти реакции относятся к кислотно-основным.
6) Особняком от первых двух групп реакций стоят реакции, в которых с концентрированными растворами щелочей реагируют амфотерные металлы и некоторые неметаллы:
2OH- + Be + 2H2O = [Be(OH)4]2- +H2  , 2OH- + Cl2 = Cl- + ClO- + H2O,
, 2OH- + Cl2 = Cl- + ClO- + H2O,
2NaOHк + Be +2H2O = Na2[Be(OH)4]р +H2  , 2KOHк + Cl2 = KClр + KClOр + H2O.
, 2KOHк + Cl2 = KClр + KClOр + H2O.
7) Все нерастворимые гидроксиды (в том числе и основания) легко разлагаются при нагревании.
Растворимые и малорастворимые основания можно получить при взаимодействии с водой соответствующих металлов или оксидов, а нерастворимые - осаждением щелочью из растворов солей.
Задание:
Приведите уравнения реакций, характеризующие химические свойства а) гидроксида калия, б) гидроксида магния, в) аммиака.
2.Получите двумя способами а) гидроксид натрия, б) гидроксид кальция, в) гидроксид лития. 4.Получите из двух различных веществ а) гидроксид магния, б) гидроксид марганца(II), в) гидроксид меди(II).
3.Осуществите превращения: NiO - NiSO4 - Ni(OH)2 - Ni(NO3)2.
Кислоты
К кислотам относятся:
а) ковалентные гидроксиды, соответствующие кислотным оксидам - кислородсодержащие кислоты;
б) ковалентные гидриды - бескислородные кислоты. (По традиции "кислотами" называют водные растворы ковалентных гидридов, например, раствор хлороводорода называют соляной (хлороводородной) кислотой, раствор сероводорода - сероводородной кислотой и т.п. Соответствующие безводные газообразные соединения "кислотами" не называют)
Кроме того, кислотами также являются некоторые ионные вещества, содержащие ионы оксония. Это устойчивые только при низких температурах "соли оксония": (H3O)Cl, (H3O)Br, (H3O)2SO4 и некоторые другие. По химическим свойствам растворы этих " солей оксония" ничем не отличаются от растворов соответствующих молекулярных кислот - соляной, бромоводородной, серной и т. д.
Большинство кислотных гидроксидов (оксокислот) - молекулярные вещества. Исключение составляет нерастворимая в воде кремниевая кислота (ее состав только упрощенно отражается формулой H2SiO3) и некоторые другие кислоты.
Растворение кислот в воде - химическое растворение. При растворении кислоты в воде протекает КОР, необратимая в случае сильной кислоты и обратимая в случае слабой:
HNO3 + H2O = H3O+ + NO3-
CH3COOH + H2O = H3O+ + CH3COO-
Способность кислот отдавать протоны определяет наиболее характерные химические свойства этих веществ:
1) Все кислоты реагируют с веществами, содержащими очень сильные частицы-основания: O2-, N3- и т. п., то есть прежде всего с основными и амфотерными оксидами.
2) Все кислоты реагируют с растворамищелочей.
3) Растворы сильных кислот реагируют с солями и их растворами (содержат анионные основания)
H3O+ + NO2- = HNO2 + H2O,
H3O+ + CH3COONa = CH3COOH + Na  + H2O,
+ H2O,
HClр + KNO2р = HNO2р + KClр;
HClp + CH3COONaкр = CH3COOHp + NaClp.
Образующаяся слабая кислота может быть еще и нерастворимой или летучей:
2H3O+ + SiO32- = H2SiO3  + 2H2O,
+ 2H2O,
2H3O+ + FeS = Fe2+ + H2O + H2S  ,
,
H2SO4 + Na2SiO3 = H2SiO3  + Na2SO4,
+ Na2SO4,
2HBr + FeS = FeBr2 + H2S  , что еще более способствует смещению равновесия вправо.
, что еще более способствует смещению равновесия вправо.
Летучие кислоты выделяются из реакционной смеси и в том случае, когда с безводной солью этой кислоты реагирует нелетучая (точнее, значительно менее летучая) кислота:
H2SO4конц + NaClкр = NaHSO4кр + HCl  ,
,
H3PO4ж + CH3COONaкр = NaH2PO4кр + CH3COOH  .
.
Если образующаяся слабая кислота неустойчива, при реакции выделяется газообразный кислотный оксид. В этом случае растворы сильных кислот реагируют и с нерастворимыми солями:
2H3O  + CaCO3 = Ca2
+ CaCO3 = Ca2  + CO2
+ CO2  + 3H2O,
+ 3H2O,
2HNO3р + CaCO3кр = Ca(NO3)2р + CO2  + H2O.
+ H2O.
Реакции между растворами солей и сильных кислот протекают и в тех случаях, когда образуется нерастворимая соль:
Cl- + Ag+= AgCl  ,
,
HCl + AgNO3 = AgCl  + HNO3.
+ HNO3.
4) Растворы сильных кислот реагируют с металлами, стоящими в ряду напряжений левее водорода.
5) Многие кислоты при нагревании разлагаются. Некоторые кислоты легко разлагаются даже в водных растворах:
H2CO3 = CO2  + H2O (при образовании практически полностью разлагается),
+ H2O (при образовании практически полностью разлагается),
H2SO3 = SO2  + H2O (неустойчива в концентрированных растворах и при нагревании).
+ H2O (неустойчива в концентрированных растворах и при нагревании).
Растворимые оксокислоты можно получить при взаимодействии соответствующего кислотного оксида с водой. Слабые кислоты получаются из солей под действием сильных кислот.
Бескислородные кислоты получают, растворяя соответствующие гидриды в воде.
Задание:
1. Предложите способы получения серной, соляной и фосфорной кислоты.
2. Приведите уравнения реакций, характеризующие химические свойства а) серной кислоты, б) кремниевой кислоты, в) соляной кислоты.
3. Осуществите превращения: Cl2 - HCl - CaCl2 - AgCl.
Не нашли, что искали? Воспользуйтесь поиском: