
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Минский государственный высший
Авиационный колледж
Х и м и Я
Задачи и упражнения
Учебно-методическое пособие
Минск
УДК 54
ББК 24
Х 46
С о с т а в и т е л ь
Н. А. БОРУШКО
Р е ц е н з е н т ы:
Н. П. СОЛОВЕЙ
доцент кафедры «Химия» БГУИР,
кандидат технических наук
Е. В. БУКО
ст. преподаватель кафедры
«Техническая эксплуатация воздушных судов и двигателей» МГВАК
Одобрено и рекомендовано к изданию
Научно-методическим советом МГВАК
(протокол от 27 мая 2011 года № 10)
Х 46 Химия. Задачи и упражнения: учебно-методическое пособие / сост. Н. А. Борушко. –
Минск: МГВАК, 2011. – 72 с.
Пособие написано в соответствии с действующей программой по химии. В нем представлен необходимый учебный материал для решения типовых задач по основным разделам курса «Химия», а также приведены примеры их решения, подобраны вопросы и задания.
Предназначено для курсантов (студентов) всех специальностей.
© МГВАК, 2011
ОСНОВНЫЕ КЛАССЫ
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Неорганические соединения могут классифицироваться как по составу, так и по свойствам (см. рисунок). По составу они подразделяются на простые вещества, состоящие из атомов одного и того же элемента (Н2, О2), и сложные вещества, которые состоят из атомов разных элементов (СО2, КОН).
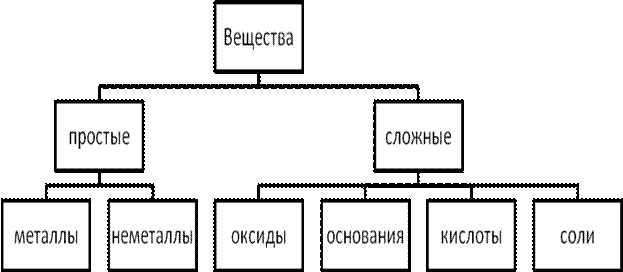

Классификация основных классов неорганических соединений
Металлы
К металлам относятся простые вещества, обладающие характерными свойствами, главные из которых проявляются в способности их атомов образовывать элементарные положительные ионы, а также простые вещества с металлическим типом связи. В сложных ионах или полярных молекулах атомы металлических элементов всегда образуют положительные центры.
При обычных условиях металлы – твердые кристаллические вещества (кроме Hg) с характерным металлическим блеском, ковкие, обладают хорошей тепло- и электропроводностью фото- и термоэлектронной эмиссией. В парообразном состоянии металлы являются диэлектриками.
Металлы классифицируют по различным признакам или свойствам, являющимися общими для ряда металлов, например, плотность, цвет и т. д. Основой для классификации металлов может служить Периодическая система элементов Менделеева. Исходя из способа застраивания электронами электронных оболочек атомов, к металлам относятся s -элементы (кроме H и He), все d- и f -элементы. Из числа p -элементов к металлам можно отнести элементы, расположенные в периодической системе слева от границы, проведенной между Вe и В, Al и Si, Ga и Ge, Sb и Fe, Po и At. Следует отметить, что Hg, Ga, Sb, Sn, Bi, Fe, Po имеют не типичные для металлов кристаллические решетки переходного характера.
Химические свойства металлов обусловлены способностью атомов металлических элементов к отдаче электронов, т. е. к проявлению восстановительных свойств. Так как мера прочности связи электрона с ядром определяется энергией ионизации, то чем ниже энергия ионизации, тем выше восстановительная способность. Самой низкой энергией ионизации обладают s -элементы 1 группы главной подгруппы периодической системы, т. е. щелочные металлы.
Атомы металлических элементов, взаимодействуя с окислителями
(в зависимости от природы металла), могут проявлять постоянные или переменные степени окисления.
Ионы металлов с низшей степенью окисления (Sn2+, Fe2+ и др.) могут существовать в растворе в свободном состоянии и являются восстановителями. Ионы же металлов с высшей степенью окисления (Cr6+, Mn7+ и др.) являются окислителями. Однако говоря о химической активности металлов, нельзя забывать, что только в свойствах изолированных атомов проявляется прямая зависимость от их электронной структуры.
Характер изменения свойств металлов как простых веществ часто не соответствует характеру изменения этих свойств свободных атомов и определяется суммой энергий ионизации и прочности кристаллической решетки. Химическая же активность металлов в водных растворах кислот и солей определяется алгебраической суммой трех энергетических характеристик: энергии ионизации (Δ Н > 0), энергии разрушения кристаллической решетки (Δ Н > 0) и энергии гидратации (Δ Н < 0). Алгебраическая сумма всех трех видов энергии и определяет численное значение электродного потенциала металла (ψ) и, следовательно, положение его в электрохимическом ряду активности.
Большинство металлов реагирует с кислородом, образуя оксиды.
Металлы, стоящие в электрохимическом ряду до Аl, соединяются с кислородом весьма энергично и при обычных условиях на воздухе всегда покрываются оксидной пленкой. Металлы от Мn до Н соединяются с кислородом также при обычных условиях, Сu, Hg,
Ag – при нагревании, Au, Pt не окисляются. Переходные металлы,
обладающие переменной степенью окисления, образуют три вида окислов. Оксиды, в которых металл находится в низшей степени окисления, имеют основной характер, в высшей – кислотный, в промежуточной – амфотерный.
Металлы, стоящие в ряду напряжений левее водорода, окисляются ионами гидроксония (Н3О+) и вытесняют водород из разбавленных растворов кислот, исключая азотную кислоту. Самые активные из них (до Zn) окисляются как в водной, так и в кислой среде, а металлы, имеющие амфотерные пленки, – и в щелочной среде.
Концентрированная серная кислота окисляет все металлы, за исключением благородных. Окислитель – анион SO42−, который в зависимости от активности металла восстанавливается до SO2 малоактивными металлами, до S и H2S – активными металлами.
В азотной кислоте (как в концентрированной, так и в разбавленной) окислитель – анион NO3−. С концентрированной азотной кислотой взаимодействуют почти все металлы, за исключением Al, Fe и Cr, которые пассивируются, т. е. покрываются защитной окисной пленкой. Основной продукт восстановления NO3− – NO2, иногда NO, если металл очень активный (щелочной или щелочно-земельный).
Характер взаимодействия металлов с разбавленной азотной кислотой зависит от активности металла и степени разбавления кислоты. Малоактивные металлы восстанавливают NO3− до NO, активные – до NO2. Продукт восстановления очень разбавленной кислоты активными металлами – аммиак (NH3), который в водном
растворе с избытком кислоты дает аммонийную соль NH4NO3 (NH4+).
Амфотерные металлы при нагревании взаимодействуют с водными растворами щелочей, вытесняя водород из ионов гидроксония (H3O+).
Не нашли, что искали? Воспользуйтесь поиском: