
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Углеродные адсорбенты
Адсорбция и ионный обмен в очистке воды.
Технологическая схема ионообменного обессоливания воды.
Дать определение адсорбции, виды адсорбции, определение адсорбента, ио, классификация ионитов, схема ио обессоливания воды
Физико-химические основы очистки воды адсорбцией
План
1. Адсорбция. Основные понятия и определение
2. Адсорбенты
Адсорбция. Основные понятия и определение
Адсорбция - это процесс концентрирования отдельных веществ или компонентов раствора на поверхности твердой фазы при самостоятельном переходе вещества из газовой фазы или раствора к поверхности раздела фаз.
Адсорбционное равновесие определяется двумя процессами - притяжением молекул к поверхности под действием межмолекулярных сил и тепловым движением молекул, которое направлено на восстановление концентраций на поверхности и в объеме фазы.
Адсорбентом, или веществом, на котором происходит адсорбция является твердое вещество. Хотя в отдельных случаях адсорбция может происходить на поверхности жидкости. То есть, адсорбция может быть на границе раздела фаз газ - твердое вещество, жидкость - твердое вещество, газ-жидкость и жидкость - жидкость.
Адсорбция жидкостью происходит, если вяжущее вещество наносят тонкой пленкой на твердый носитель. Это вяжущее вещество имеет свойства жидкости, но она нанесена такой тонкой пленкой, что адсорбция происходит лишь на поверхности (газожидкостная хроматография).
Компонент, который адсорбируется, называют адсорбатом или адсорбтивом. Вещество, которое адсорбирует, называется адсорбентом.
Процесс адсорбции в газовой фазе зависит от:
- площади поверхности адсорбента;
- парциального давления компонента.
При адсорбции веществ из раствора на процесс влияют:
- концентрация раствора,
- энергия взаимодействия компонента с адсорбентом,
- энергия взаимодействия компонента с растворителем,
- энергия взаимодействия растворителя с адсорбентом.
Энергию адсорбции можно описать уравнением:
Еад= Еа - Ер – Еr
где Еад – энергия адсорбции из раствора;
Еа – энергия взаимодействия компоненту с адсорбентом;
Ер - энергия взаимодействия компоненту с растворителем;
Еr - энергия взаимодействия растворителя с адсорбентом.
О влиянии растворителя на процесс адсорбции можно судить, исходя из растворимости вещества. Как правило, чем больше растворимость вещества, тем меньше ее адсорбция и, наоборот, чем меньше растворимость вещества, тем лучше проходит его адсорбция.
Процесс адсорбции является равновесным процессом. Концентрирование компонента на поверхности адсорбента проходит за счет сил межмолекулярного притяжения, а тепловое движение молекул растворителя и компонента, направленное на выравнивание концентрации компонента в растворе и на поверхности адсорбента, оказывает содействие процессу десорбции. Поэтому при контакте раствора с адсорбентом устанавливается определенное динамическое равновесие, при котором равновесной концентрации компонента в растворе отвечает определенная концентрация компонента на поверхности адсорбента.
Растворимость вещества с процессом адсорбции в определенной мере связывает правило Траубе, согласно которому в гомологическом ряде карбоновых кислот, произведение растворимости этих веществ на коэффициент распределения является величиной постоянной.
К∙Сs = const
где К – коэффициент распределения:
К = СТ / СР;
Сs – максимальная растворимость вещества в данном растворителе;
СТ – концентрация компоненту в твердой фазе;
СР - концентрация компоненту в растворе.
В зависимости от характера взаимодействия адсорбтива с адсорбентом, адсорбцию разделяют на:
- физическую;
- активированную;
- хемосорбцию.
Физическая адсорбция - это адсорбция за счет сил межмолекулярного взаимодействия Ван-дер-Ваальса. Характеризуется невысокими энергиями адсорбции 1-10 кДж / моль. При физической адсорбции процесс зависит лишь от относительной площади поверхности или адсорбционного объема адсорбента и не зависит от химических свойств веществ, которые адсорбируются. Физическая адсорбция не специфическая, полностью обратимая и происходит с большой скоростью. В особенности характерна для веществ, которые адсорбируются из паро-газовой фазы.
Активированная адсорбция - это адсорбция, которая проходит с образованием специфических соединений между компонентом и адсорбентом с включением молекул компонента в кристаллическую структуру адсорбента. Такая адсорбция специфическая, необратимая, происходит медленно, с повышением температуры скорость возрастает и характеризуется высокими значениями энергии адсорбции ≈100 кДж / моль.
Хемосорбция - это адсорбция, которая происходит по счет связывания компонента с адсорбентом по определенным химическим реакциям. Эти процессы целиком описываются химическими реакциями, по которым они протекают, и энергия этих процессов равна энергии соответствующих химических реакций.
Если компонент находится в газовой фазе и контактирует с адсорбентом, то степень заполнения адсорбционной поверхности зависит от парциального давления компонента в растворе. Если адсорбция происходит из раствора, то поверхность адсорбента полностью заполненная молекулами компонента и молекулами растворителя. Относительная степень заполнения поверхности деления фаз суммой всех молекул (Q) всегда равняется 1. Тем не менее, соотношение количества компонента и растворителя в адсорбционном объеме и растворе будет разной. Эта разность соотношений называется избирательностью адсорбции:
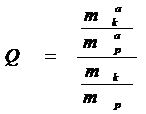 > 1
> 1
где 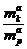 - концентрация компонента в адсорбционном объеме;
- концентрация компонента в адсорбционном объеме;
 - концентрация компонента в растворе.
- концентрация компонента в растворе.
То есть, относительная величина заполнения поверхности деления фаз молекулами определенного компоненту (Qі) является функцией равновесной концентрации молекул компонента в адсорбционном слое и в равновесном растворе и характеризует избирательность адсорбции этого вещества из водного раствора. В случае отсутствия избирательности соотношение компонентов в адсорбционном слое и в растворе одинаковое. Избирательность адсорбции определяет принципиальную целесообразность адсорбционной технологии.
Об эффективности процесса адсорбции можно судить не только по избирательности, но и по величине удельной адсорбционной емкости - это количество адсорбированного вещества в единицы массы или объема адсорбента.
Считается, что при физической адсорбции величина адсорбции не зависит от структуры молекулы вещества, которое адсорбируется, не зависит от его химических свойств, а определяется в основном площадью поверхности адсорбента. Исходя из этого, можно сказать, что удельная адсорбционная емкость будет возрастать при повышении пористости сорбента, то есть при уменьшении размеров пор. Если при одинаковом общем объеме всех пор снижать величину их эффективного радиуса, то площадь поверхности раздела фаз будет возрастать. Тем не менее, размеры пор можно уменьшать к определенной границе.
В том случае, если эффективный радиус пор будет меньше, чем размеры сорбирующейся молекулы, то площадь поверхности пор теряет свой физический смысл, как характеристика границы деления двух фаз.
Зависимость величины удельной адсорбции от равновесной концентрации компонента в растворе называется изотермой адсорбции растворенного вещества.
Ее можно определить экспериментально, а можно рассчитать теоретически. При экспериментальном определении поступают таким образом:
Задавшись разными концентрациями растворов, смешивают их с адсорбентом. На одинаковых объемах растворов используют одинаковые навески адсорбента. Потом определяют равновесные концентрации компонента и рассчитывают величину удельной адсорбции.
| С | Ср | а |
| С1 | Ср1 | а1 |
| С2 | С р1 | а2 |
| Сn | Срn | аn |
Величину адсорбции рассчитывают по формуле:

где С – начальная концентрация компонента;
Ср – конечная концентрация компонента;
Vp – объем раствора;
та – масса адсорбента.
Чтобы оценить равновесные условия адсорбционной очистки воды от растворимых веществ нужно знать удельный адсорбционный объем адсорбента (его основную характеристику) и изотерму адсорбции вещества из раствора.
Границы применения адсорбционных методов для очистки воды определяются стоимостью адсорбента и его эффективными дозами.
О целесообразности процесса адсорбции с экономической точки зрения можно судить по отношению объема очищенной воды (раствора Vp) к объему использованного адсорбента (Vа). Экономически целесообразным считается соотношение:

Адсорбенты
В практике водоочистки широко используются углеродные адсорбенты, синтетические полимерные адсорбенты и минеральные адсорбенты.
Органические адсорбенты делятся на углеродные и синтетические адсорбенты.
Минеральные адсорбенты – это, в основном, природные алюмосиликаты и глинистые материалы. Наиболее широкое применение для извлечения органических веществ нашли углеродные адсорбенты.
Углеродные адсорбенты
Это, в основном, активированный уголь, который получают из древесины и из разнообразного растительного сырья. Кроме того, к углеродным сорбентам относят сажу, бурый уголь, антрацит. Углеродные адсорбенты могут быть разными по своей пористости. В целом, по этому признаку их разделяют на 4 группы:
- непористые адсорбенты;
- однороднокрупнопористые (однородно-велико пористые);
- однородномелкопористые;
- неоднороднопористые.
Как правило, углеродные сорбенты содержат разнообразные поры, которые условно можно разделить на 3 группы (по их размерам). Главным критерием, который используют для оценки пор, является эффективный радиус пор:

где S - площадь сечения поры;
Р - периметр поры
По эффективному радиусу поры делятся на:
- макропоры (Re > 100 Нм);
- мезопори (100 Нм > Re > 1,5  1,6 Нм);
1,6 Нм);
- микропоры (1,5  1,6 Нм > Re > 0,6 Нм).
1,6 Нм > Re > 0,6 Нм).
Если Re < 0,6 Нм - то понятие поры теряет физическое содержание, как граница раздела фаз.
Размеры некоторых молекул органических веществ:
- метиламин CH3NH2 – 0,52 Нм;
- этиламин CH3CH2NH2 – 0,65 Нм;
- НП-3 – 1,8 Нм;
- ОП-10 – 6,9 Нм.
НП-3 и ОП-10 - ПАР
Микропоры составляют основную часть адсорбционного объема при адсорбции веществ, которые имеют маленькие и средние по размеру молекулы. При адсорбции высокомолекулярных соединений адсорбционный объем составляют в основному макро- и мезопоры.
Следует отметить, что площадь раздела фаз в значительной мере возрастает при переходе от макропористого к мезо- и к микропористостому адсорбенту.
Установлено, что удельная площадь поверхности макропор адсорбента составляет 20-40 тысяч м2/кг адсорбента, мезопор до 400 000 м2/кг адсорбента.
Не нашли, что искали? Воспользуйтесь поиском: