
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретические сведения. Постоянная Планка принадлежит к числу универсальных постоянных, как, например, скорость света в вакууме
Постоянная Планка принадлежит к числу универсальных постоянных, как, например, скорость света в вакууме, заряд электрона, его масса и т. д. По своим единицам измерения она выражается произведением энергии на время, в связи с чем названа Планком квантом действия.
Целью настоящей работы является определение величины постоянной Планка путём изучения линейчатого спектра излучения атома водорода, так как спектр излучения является характеристикой данного вещества, поскольку данное вещество излучает волны, свойственные только ему.
Различают сплошные, полосатые и линейчатые спектры излучения.
Сплошной спектр получается при свечении раскалённых твердых тел и жидкостей.
Полосатый спектр характерен для свечения паров и газов, состоящих из молекул.
Линейчатый спектр дают пары и газы, состоящие из отдельных атомов.
Немецкий физик Макс Планк выдвинул гипотезу о том, что атом ве-щества, будучи возбуждён, излучает свет не непрерывно, а отдельными порциями (квантами), энергия которых  , где
, где  - частота испускаемого света,
- частота испускаемого света,  - постоянная Планка.
- постоянная Планка.
Датский физик Нильс Бор применил гипотезу Планка к вопросу об излучении света атомами водорода и ряда других элементов. Он выдвинул три постулата.
1. Электрон в атоме может двигаться вокруг ядра только по опреде-лённым, т.е. "стационарным", орбитам, для которых момент импульса электрона кратен постоянной Планка, делённой на  (условия квантования радиусов орбит ):
(условия квантования радиусов орбит ):  , (1)
, (1)
где m - масса электрона, V - его скорость, r - радиус орбиты, n -целое число, называемое главным квантовым числом, n = 1,2,3....
2. При движении электрона по любой из стационарных орбит атом свет не излучает и не поглощает.
3. Переход электрона с одной стационарной орбиты на другую (с i -той на k - тую) сопровождается излучением или поглощением кванта энергии  .
.
Таким образом, частота электромагнитных волн, излучаемых атомом, определяется разностью энергий стационарных состояний атома.
Можно объяснить на основании постулатов Бора спектры излучения и поглощения атома водорода. Вокруг ядра (протона), несущего один элементарный заряд  , движется электрон. Предлагаем в первом приближении орбиту электрона считать круговой. Очевидно, что центростремительной силой, удерживающей электрон на орбите радиуса
, движется электрон. Предлагаем в первом приближении орбиту электрона считать круговой. Очевидно, что центростремительной силой, удерживающей электрон на орбите радиуса  , является кулоновская сила притяжения между электроном и ядром. Тогда уравнение движения электрона запишется так:
, является кулоновская сила притяжения между электроном и ядром. Тогда уравнение движения электрона запишется так:  , (2)
, (2)
где 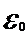 - электрическая постоянная. Решая совместно уравнения (1) и (2), получаем после простых преобразований выражение радиуса стационарных орбит атома водорода:
- электрическая постоянная. Решая совместно уравнения (1) и (2), получаем после простых преобразований выражение радиуса стационарных орбит атома водорода:  . (3)
. (3)
Видим: а) радиус ближайшей к ядру орбиты (n = 1)  м; б) радиусы стационарных орбит относятся как квадраты чисел натурального ряда, т.е. как 1:4:9:16...
м; б) радиусы стационарных орбит относятся как квадраты чисел натурального ряда, т.е. как 1:4:9:16...
Определим теперь полную энергию W электрона в атоме. Она слагается из кинетической энергии поступательного движения электрона по орбите  и потенциальной энергии притяжения электрона к ядру
и потенциальной энергии притяжения электрона к ядру  , которая должна быть отрицательной:
, которая должна быть отрицательной:  .
.
Получив из соотношения (2) выражение  для полной энергии имеем
для полной энергии имеем 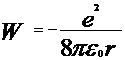 . (4)
. (4)
 Подставив в эту формулу выражение радиуса (3), получаем:
Подставив в эту формулу выражение радиуса (3), получаем:  . (5)
. (5)
По этой формуле можно рассчитать энергию электрона для любой стационарной орбиты - так называемые уровни энергии атома. На рисунке 1 схематически изображены уровни энергии атома водорода, рассчитанные по формуле (5), здесь же указаны соответствующие значения энергии. Энергия излучаемого кванта:  , частота:
, частота:  . (6)
. (6)
В видимой части водородного спектра швейцарец Бальмер обнаружил ряд спектральных линий, частоты которых определяются формулой (6) при условии, что i =2, а k =3,4,... Эти линии составляют так называемую серию Бальмера.
Используя соотношение между длиной испускаемого света  и его частотой:
и его частотой:  , из формулы (6) определим постоянную Планка.
, из формулы (6) определим постоянную Планка.
 . (7)
. (7)
По этой формуле производят расчёты.
Не нашли, что искали? Воспользуйтесь поиском: