
- Р Р‡.МессенРТвЂВВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВВнокласснРСвЂВВВВВВВВВРєРСвЂВВВВВВВВВ
- Telegram
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВВРЎР‚
- Skype
- LiveJournal
- Blogger
- РЎРєРѕРїРСвЂВВВВВВВВВровать ссылку
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретическое введение. Необратимые химические реакции протекают до полного израсходования одного из реагирующих веществ, т.е
Необратимые химические реакции протекают до полного израсходования одного из реагирующих веществ, т.е. необратимая реакция протекает только в одном направлении; обратимая же реакция может протекать как в прямом, так и в обратном направлении. Пример обратимой реакции – реакция синтеза аммиака: N2 + 3 H2 ⇆ 2 NH3.
Состояние системы, в котором скорость прямой реакции равна скорости обратной называется состоянием химического равновесия.
Количественной характеристикой системы в состоянии химического равновесия является константа химического равновесия. Для обратимой реакции, записанной в общем виде a A + b B+... ⇆ p P + q Q +.... константа химического равновесия выражается формулой:

В выражение константы равновесия входят равновесные концентрации веществ, которые находятся в газовой фазе или в растворённом состоянии.
Константа равновесия представляет собой постоянную (при постоянной температуре) величину; она не зависит от концентраций веществ, хотя и выражается через равновесные концентрации.
Процесс изменения концентраций веществ, вызванный нарушением равновесия, называется смещением (сдвигом) равновесия. Влияние различных факторов на смещение равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, то равновесие сместится таким образом, чтобы ослабить оказанное воздействие.
Частные случаи принципа Ле-Шателье:
– при увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расходования этого вещества, а при её уменьшении – в сторону образования этого вещества;
– при увеличении давления в системе равновесие смещается в сторону меньшего числа молекул газообразных веществ; при уменьшении давления – в сторону большего числа молекул газообразных веществ;
– при повышении температуры равновесие смещается в сторону эндотермической реакции; при понижении температуры – в сторону экзотермической реакции.
Законы химического равновесия можно применить к равновесию, которое устанавливается в растворе слабого электролита. Константа равновесия, соответствующая процессу диссоциации слабого электролита, называется константой диссоциации. Например, для процесса диссоциации уксусной кислоты CH3COOH ⇆ CH3COO– + H+
константа диссоциации имеет вид:

Степенью диссоциации электролита (a) называется отношение числа распавшихся на ионы молекул, к общему числу молекул в растворе. Степень диссоциации можно рассчитать по формуле
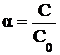
где C – молярная концентрация продиссоциировавшего вещества;
C0 – общая молярная концентрация вещества в растворе
Чистая вода – очень слабый электролит; процесс диссоциации воды может быть выражен уравнением HOH ⇆ H+ + OH–. Для любого водного раствора справедливо уравнение ионного произведения воды: C(H+)·C(OH–) = 10–14.
В любом водном растворе – как в кислом, так и в щелочном, вследствие диссоциации воды содержатся и ионы H+, и ионы OH–:
– в нейтральном водном растворе C(H+) =·C(OH–) = 10–7 моль/л;
– в кислом растворе C(H+) >·C(OH–);
– в щелочном растворе C(H+)·< C(OH–).
Кислотность или щёлочность раствора характеризуют величиной, которая называется водородным показателем и обозначается pH:
pH = –lg C(H+)
В кислом растворе pH < 7;
в нейтральном растворе pH = 7;
в щелочном растворе pH > 7.
Для расчёта pH щелочных растворов используют вспомогательную величину, которая называется гидроксильный показатель pOH:
pOH = –lg C(OH–)
pH и pOH связаны соотношением: pH + pOH = 14.
Ход работы
Опыт №1
Исследование применимости принципа Ле-Шателье к системе
FeCl3 + 3KCNS ⇄ Fe(CNS)3 + 3KCl
Опыт №2
Окраска кислотно-основных индикаторов в кислой, нейтральной и щелочной среде
Опыт №3
Влияние добавления одноимённых ионов на степень диссоциации слабых электролитов.
Список литературы
1. Общие требования и правила оформления текстовых документов: СТП СМК 4.2.3-01-2011. – Могилев: МГУП, 2011. – 43 с.
2. Практикум по неорганической химии: Учеб. пособие для хим.-техногол. спец. вузов/ З. Е. Гольбрайх –М.: Высшая школа, 1986. -350 с.
3. Общая и неорганическая химия. Конспект лекций для студентов технологических специальностей/ Огородников В. А. – Могилев: МГУП, 2005 (часть1).
4. Общая химия: учебное пособие для вузов/ Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2008. – 728с.
| <== предыдущая лекция | | | следующая лекция ==> |
| Объем и технические требования, предъявляемые к выполнению реферата. | | | В начале октября 1905 г. политическая стачка приняла всероссийский характер. |
Не нашли, что искали? Воспользуйтесь поиском: