
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Регуляция гликолиза 6 страница
Целевыми органами для транспорта аммиака являются печень, почки и кишечник. В печени:
а)аспарагин и глутамин дезаминируются соответственно аспарагиназой и глутаминазой, образующийся аммиак используется для синтеза мочевины, б)аланин вступает в реакции трансаминирования с α-кетоглутаратом, в)глутаминовая кислота подвергается окислительному дезаминированию. В кишечнике часть глутамина дезаминируется глутаминазой. После этого образованный аммиак выделяется в просвет кишечника (не более 5%) или через кровь воротной вены уходит в печень, а глутамат вступает в трансаминирование с пируватом, в результате чего аминоазот переходит на аланин и с ним также поступает в печень, В почках идет образование аммонийных солей с использованием глутамата, глутамина и аспарагина.
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость.
Гипотезы токсичности аммиака. Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы.
Наследственные и приобретенные формы гипераммониемий. Приобретенная (вторичные) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений. Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния. Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х-хромосомой. У матери также наблюдается гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения). Лабораторным критерием заболевания является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче. Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности.
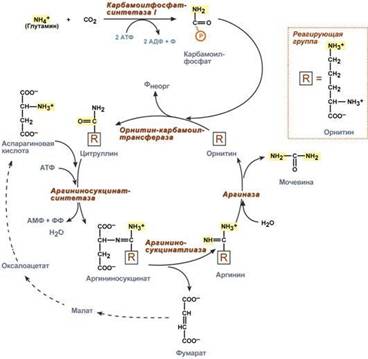 Практически весь аммиак удаляется из организма через почки в виде мочевины, которая синтезируется в печени, и в виде образующися в эпителии канальцев почек солей иона аммония. В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах. В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония). Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота. В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака. Синтез мочевины. В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином. В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ. Синтез аммонийных солей. Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей. Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой. Параллельно в эпителии происходят процессы клеточного дыхания, сопросождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+ и карбонат-ион НСО3−. Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь. Выделяемый аммиак диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммония NH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот).
Практически весь аммиак удаляется из организма через почки в виде мочевины, которая синтезируется в печени, и в виде образующися в эпителии канальцев почек солей иона аммония. В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах. В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония). Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота. В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака. Синтез мочевины. В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином. В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ. Синтез аммонийных солей. Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей. Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой. Параллельно в эпителии происходят процессы клеточного дыхания, сопросождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+ и карбонат-ион НСО3−. Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь. Выделяемый аммиак диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммония NH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот).
33. Обмен фенилаланина и тирозина. Наследственные нарушения обмена фенилаланина и тирозина. Значение серина, глицина и метионина.

 Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному. В организме фенилаланин используется только в синтезе белков. Весь неиспользованный запас аминокислоты превращается в тирозин. В этом непосредственно участвует фермент фенилаланин-4-монооксигеназа, обеспечивающий окисление ароматического кольца. Кофермент тетрагидробиоптерин в реакции окисляется до дигидроформы. Восстановление кофермента осуществляет дигидробиоптерин-редуктаза с своим коферментом НАДФН. Тирозин, помимо участия в синтезе белков, является предшественником гормона надпочечников адреналина, медиаторов норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигментов.
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному. В организме фенилаланин используется только в синтезе белков. Весь неиспользованный запас аминокислоты превращается в тирозин. В этом непосредственно участвует фермент фенилаланин-4-монооксигеназа, обеспечивающий окисление ароматического кольца. Кофермент тетрагидробиоптерин в реакции окисляется до дигидроформы. Восстановление кофермента осуществляет дигидробиоптерин-редуктаза с своим коферментом НАДФН. Тирозин, помимо участия в синтезе белков, является предшественником гормона надпочечников адреналина, медиаторов норадреналина и дофамина, гормонов щитовидной железы тироксина и трийодтиронина и пигментов.
Не нашли, что искали? Воспользуйтесь поиском: