
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Вакцинация при ревматических заболеваниях: актуальность и перспективы
Белов Б.С., Насонов Е.Л.
На протяжении всей истории человечества инфекционные болезни представляли наибольшую угрозу для здоровья людей. Известны многочисленные мифы и легенды, свидетельствующие о страхе, который испытывали люди при возникновении и распространении эпидемий «повальных» болезней. Именно этот страх заставлял людей предпринимать особые меры (сжигание трупов умерших, их одежды и жилища, «закрытие» городов и т.д.), явившиеся прообразом современных противоэпидемических мероприятий.
В наступившем XXI веке инфекционные заболевания по–прежнему остаются актуальной социальной и медицинской проблемой. Они распространены значительно шире их официальной регистрации. Инфекция является одной из ведущих причин смерти в странах с различным уровнем экономического развития. По данным ВОЗ, на долю инфекционных болезней приходится около 25% всех смертей в мире, а в развивающихся странах этот показатель возрастает до 45%. Казалось бы, что в эпоху вакцин и антибиотиков контроль над этими болезнями вполне реален, однако материалы статистики свидетельствуют о том, что в глобальном масштабе ситуация мало меняется к лучшему.
В современной ревматологии коморбидные инфекции (КИ) оказывают значительное влияние на морбидность и летальность, особенно при системных болезнях соединительной ткани. По нашим данным, в 2002–2005 гг. частота КИ у стационарного контингента больных ревматическими заболеваниями (РЗ) составила 9,7%. При этом частота вторичных инфекций была максимальной у стационарных больных ревматоидным артритом (РА) и системной красной волчанкой (СКВ) и составила 38,1 и 19,7%, соответственно [1].
О высокой частоте КИ, осложняющих течение РА, известно в течение последних 40 лет. КИ у больных РА развиваются в 1,5 раза чаще, чем в популяции, и являются второй по частоте (после активности болезни) причиной смерти пациентов [2].
В соответствии с результатами когортного исследования к наиболее частым инфекционным осложнениям РА относятся (в порядке убывания): септический артрит, остеомиелит, инфекции кожи и мягких тканей, пневмония [3]. По данным этих же авторов, основными предикторами развития КИ при РА являются хронические заболевания легких, лейкопения, внесуставные проявления болезни, наличие РФ, ускоренная СОЭ, а также лечение глюкокортикоидами (ГК) [4].
В ходе годового проспективного исследования показано, что применение метотрексата (МТ) у больных РА (n=77) по сравнению с контрольной группой таких же пациентов, не получавших цитостатики (n=151), приводило к достоверному повышению общего числа вторичных КИ (62 и 47% соответственно, p<0,05), а также к нарастанию необходимости применения антибиотиков для их лечения (40 и 26% соответственно, p<0,05) [5].
При СКВ частота КИ за последние 30 лет существенно не изменилась и составляет от 27 до 55% (рис. 1).
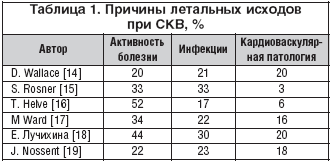
В качестве причин летальности при СКВ инфекции занимают вторую позицию, уступая лишь активности болезни, а в некоторых работах – опережая ее (табл. 1), и, по данным мультивариантного анализа, относятся к основным предикторам летального исхода [20].
Выделен ряд факторов риска развития КИ при СКВ, имеющих отношение как к самому заболеванию (активность, длительность, число обострений, люпус–нефрит, анемия, лейкопения, высокий уровень С–РБ), так и к его лечению (пульс–терапия ГК, применение цитотоксинов и т.д.). Однако вклад каждого из перечисленных факторов весьма разнится в зависимости от когорты наблюдавшихся больных СКВ. В частности, пульс–терапия метилпреднизолоном в сочетании с циклофосфамидом (ЦФ) явилась одним из ведущих факторов риска КИ и приводила к их развитию в 45% случаев. При этом частота так называемых серьезных инфекций, требующих госпитализации и лечения антиинфекционными препаратами, также была достаточно высокой (37%). У больных, получавших парентеральную комбинированную терапию ЦФ и ГК, КИ возникали достоверно чаще, чем при изолированном лечении ГК (45 и 12% соответственно, (р=0,001) [21].
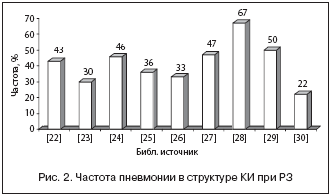
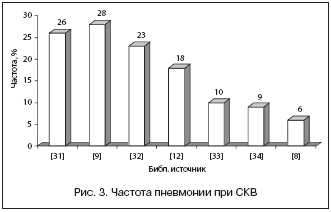
В целом в структуре инфекционных осложнений среди пациентов с РЗ лидирующее место занимают пневмонии (22–67%) (рис. 2). Их частота у больных СКВ составляет, по разным данным, от 6 до 23% (рис. 3). Несколько меньше этот показатель среди пациентов с РА – 2,4–8,3% [35,36], или 5,9–17 случаев на 1000 пациенто/лет [3,27–29,36]. Ретроспективный анализ показал, что факторами риска развития пневмонии у больных РА явились высокая активность болезни, наличие хронических заболеваний легких, отсутствие приема базисных противовоспалительных препаратов (БПВП) и монотерапия ГК [37]. Смертность от пневмонии у больных РЗ колеблется от 11 до 22% [25,27], при СКВ – 23–27% [19,33,38,39]. По данным Е. Л. Лучихиной, инфекции занимали первое место среди причин смерти стационарных больных, и почти в четверти случаев это была пневмония [18]. При РА летальность от пневмонии составила 8–22% [2,40].
В последние десятилетия в ревматологии произошли существенные изменения, связанные в первую очередь с активным внедрением в клиническую практику генно–инженерных биологических препаратов (ГИБП), действие которых направлено на специфические компоненты патогенеза РЗ. Однако по мере накопления мирового клинического опыта становилось понятно, что применение этих препаратов ассоциируется с нарастающим риском развития инфекций различной природы и локализации.
На сегодняшний день механизмы, лежащие в основе нарастания риска инфекций, обусловленных применением ГИБП, до конца не раскрыты. Однако восприимчивость больных к определенным типам инфекции может быть объяснена тем, что «мишенями» указанных препаратов являются ключевые компоненты иммунной защиты человека, а именно фактор некроза опухоли–α (ФНО–α), интерлейкин–1, интерлейкин–6, В– и Т– лимфоциты и др.
В настоящее время установлено, что частота серьезных бактериальных инфекций при лечении ингибиторами ФНО–α (иФНО–α) возрастает в 2–4 раза, особенно в первые 90 дней лечения, и увеличивается при сочетании с МТ. По данным плацебо–контролируемых исследований, частота инфекций и их структура являются примерно одинаковыми для инфликсимаба, этанерцепта (кроме туберкулеза), адалимумаба и цертолизумаба пэгола.
Лечение абатацептом также ассоциируется с умеренным риском развития бактериальных инфекций. Этот риск нарастает при одновременном применении абатацепта и иФНО–α.
Частота серьезных инфекций, развивавшихся при лечении тоцилизумабом, была аналогичной таковой у больных, получавших иФНО–α. Также сходной была структура инфекционных осложнений, которые включали пневмонию, флегмону, herpes zoster–инфекцию, бактериальный артрит и реактивацию латентных инфекций, в т.ч. микобактериальных. В отдельных случаях серьезные инфекции приводили к летальному исходу.
В соответствии с результатами рандомизированных клинических исследований при лечении ритуксимабом (РТМ) отмечено повышение частоты развития инфекций (в т.ч. серьезных инфекций дыхательных и мочевыводящих путей), однако достоверных отличий от препаратов сравнения не наблюдалось [41–43]. По данным французского регистра, основными факторами риска развития тяжелых инфекций у больных РА при лечении РТМ были хроническая легочная и/или сердечная недостаточность, внесуставные проявления болезни, низкий исходный уровень IgG (<6 г/л) [44]. В целом частота серьезных инфекций среди больных РА, получавших РТМ, составила 5,0, в группе контроля 3,4 на 100 пациенто/лет [45]. При длительном проспективном наблюдении за обширной когортой больных РА (1053 чел.), получавших ≥1 инфузии РТМ, показана сохраняющаяся (но не нарастающая) частота развития инфекций (включая тяжелые) [46].
В настоящее время в арсенале врачей имеется достаточное количество антиинфекционных препаратов. Но только с их помощью решить все проблемы, связанные с инфекциями в ревматологии, как и в других областях медицины, невозможно. Поэтому в ближайшем будущем большое внимание будет уделено созданию, совершенствованию и активному внедрению в клиническую практику различных вакцин.
Иммунизация является одним из самых эффективных методов профилактики инфекций и наиболее важным достижением медицины ХХ века. В то же время большинство хронических заболеваний (прежде всего аутоиммунной природы) многие практикующие врачи продолжают рассматривать, как противопоказания для вакцинации.
Не могут ли механизмы, которые обусловливают повышенную восприимчивость больных РЗ к инфекциям, вызвать ослабленный иммунный ответ на вакцину? Не приведет ли вызванная вакциной активация иммунной системы к развитию или обострению уже имеющегося РЗ? Эти два вопроса оставались до последнего времени главными сдерживающими факторами широкого применения вакцинации в ревматологии. Считалось, что такой подарок человечеству от Эдварда Дженнера и Луи Пастера, как вакцинация – это своего рода «троянский конь». На протяжении десятилетий утверждалось, что в ответ на вакцинацию в ходе длительной моноклональной активации иммунокомпетентных клеток может произойти сбой в работе механизмов, отвечающих за иммунологическую толерантность к аутологичным структурам человеческого организма.
В свете изложенного весьма показательны результаты своеобразного аудита, проведенного французскими и британскими авторами [47,48]. Оказалось, что частота охвата вакцинацией против гриппа и пневмококковой инфекции в обеих последовательных когортах больных РЗ была достаточно низкой (субоптимальной) и составила 28 и 37% соответственно. В качестве одной из главных причин этого фигурировало отсутствие рекомендаций в отношении вакцинации со стороны лечащих врачей.
До настоящего времени механизмы развития аутоиммунных заболеваний после вакцинации до конца не выяснены. Некоторые исследователи рассматривают в качестве «виновников» адъюванты и микробные агенты, содержащиеся в вакцинах [49,50]. При этом наиболее часто описываемым механизмом развития аутоиммунных реакций в ответ на действие инфекционного агента является феномен молекулярной (или антигенной) мимикрии. Суть его состоит в том, что при наличии у макроорганизма и компонентов вакцины общих антигенных детерминант инициируемый иммунный ответ приводит к возникновению перекрестных реакций со сходными аутоантигенами поражаемых тканей человека. Особенность этого феномена – сохранность аутоиммунных реакций даже после элиминации первичного антигена («мавр сделал свое дело, мавр может уходить»). Полагают, что данный эффект обеспечивается изменением антигенной структуры белковых молекул макроорганизма, высвобождением из клеток большого количества неизмененного белка (вирус–опосредованная токсичность), экспрессией «спящего» гена, высокой локальной концентрацией цитокинов. Эти механизмы могут обусловить аутоиммунный процесс (как по отдельности, так и в сочетании).
Также существует мнение, что с проведением массовой иммунизации уменьшилась частота инфекционных заболеваний и таким образом произошло переключение с Th2– иммунного ответа на Th1– обусловленный аутоиммунитет, что и привело к нарастанию аутоиммунной патологии [51,52]. Вместе с тем имеющиеся многочисленные данные свидетельствуют об отсутствии какого–либо значимого негативного влияния иммунизации на течение основного РЗ.
Как отмечалось выше, наиболее актуальными в отношении морбидности и летальности у больных РЗ являются инфекции дыхательных путей. Данное обстоятельство является объяснением того, что подавляющее число работ по вакцинации при РЗ посвящено предупреждению инфекций указанной локализации.
В конце 1970–х гг. в США в рамках Национальной программы по вакцинации против гриппа было выполнено 5 аналогичных по дизайну исследований [53–57], имевших целью изучить эффективность и переносимость моно– и бивалентной противогриппозных вакцин у больных СКВ в неактивной фазе заболевания. В абсолютном большинстве случаев продемонстрирована высокая иммуногенность вакцины, показатели сероконверсии1 были аналогичны таковым в контрольной группе. Обострение заболевания зарегистрировано у 4 из 125 (3,2%) вакцинированных больных СКВ и у 1 из 21 (4,8%) пациента без вакцинации.
По данным M. Abu–Shakra и соавт., применение трехвалентной противогриппозной сплит–вакцины у 24 больных СКВ не привело к изменению индекса активности (SLEDAI) ни в одном случае в течение 12–недельного периода наблюдения. На 6–й неделе наблюдалось транзиторное повышение титров аутоантител (анти–Sm, анти–RNP, анти– Ro, анти–КЛ) без признаков обострения заболевания. По сравнению с общей популяцией поствакцинальная концентрация антител к вирусу гриппа была меньшей (но не ниже протективного уровня), что наблюдалось, как правило, у пациентов, получавших лечение преднизолоном в суточной дозе >10 мг или азатиоприном (но не МТ). В целом по группе частота сероконверсии в зависимости от вирусного штамма колебалась от 37,5 до 62,5% [58–60].
В исследованиях голландских авторов наблюдаемое у больных СКВ снижение Т–клеточного иммунного ответа на противогриппозную вакцину ассоциировалось с терапией преднизолоном и/или азатиоприном [61]. Повторная (бустерная) вакцинация вела к нарастанию показателей сероконверсии и среднего геометрического титра (СГТ) поствакцинальных антител только у больных СКВ, которые не были вакцинированы в течение предыдущего года [62].
В 1984 г. S. Croft и соавт. продемонстрировали серологическую безопасность (отсутствие поствакцинальной поликлональной В–клеточной активации) у 18 больных СКВ, иммунизированных 23–валентной пневмококковой полисахаридной вакциной. Иммуногенность вакцины у пациентов была близкой к таковой в здоровом контроле, т.е. 83 и 100% соответственно [63].
Из 73 больных СКВ, иммунизированных вышеуказанной вакциной, удвоение титров специфического антипневмококкового IgG наблюдалось в 85,7% случаев; в течение 3 месяцев наблюдения обострений заболевания или иных побочных эффектов не наблюдалось [64].
Как отмечается в редакционной статье журнала «Journal of Rheumatology», «…безопасность и иммуногенность вакцин против пневмококка и вируса гриппа, о которых впервые сообщалось в конце 1970–х гг., теперь при СКВ подтверждена. Доказательства обострения болезни отсутствуют. У больных СКВ формируются протективные антитела, несмотря на активность болезни и применение иммуносупрессоров. Интересно, что гуморальный иммунный ответ на эти вакцины является антиген–специфическим и не зависит от продукции анти–ДНК–антител, а индукция аутоиммунного феномена является редким событием» [65].
В ходе рандомизированного двойного слепого плацебо–контролируемого исследования изучали иммуногенность и безопасность трехвалентной противогриппозной вакцины у 126 больных РА. Частота обострений у иммунизированных РА–пациентов была аналогичной таковой у больных без вакцинации, а параметры нарастания титров специфических антител были сопоставимы со здоровым контролем. Показатели сероконверсии у иммунизированных больных РА составили 77, 50 и 37% для А/Н3–, А/Н1– и В–антигенов вакцины соответственно [66].
В настоящее время активно изучается иммуногенность и безопасность вакцинации у больных РА, получающих как БПВП, так и ГИБП. Показано, что у больных РА трехвалентная сплит–вакцина против гриппа генерирует хороший гуморальный ответ, хотя и меньший, чем в здоровом контроле. Лечение преднизолоном, МТ, инфликсимабом или этанерцептом не оказывает существенного влияния на уровень поствакцинального ответа. Через 6 недель после вакцинации показатели сероконверсии были следующими: 67% для В–антигена, 53% для А/Н3– и А/Н1–антигенов. Обострение РА не отмечено ни в одном случае в течение 6 месяцев периода наблюдения [67].
В исследование, выполненное японскими авторами, были включены 63 больных РА, из которых 27 получали иФНО–α (11–инфликсимаб, 16 – этанерцепт), 36 – БПВП, а также 52 здоровых лица (контрольная группа). Через 4–6 недель после иммунизации трехвалентной противогриппозной вакциной более высокие показатели сероконверсии наблюдались среди пациентов, получавших иФНО–α, и составили для А/Н1 и А/Н3 по 44,4%, В–антигена – 26,6%, в то время как при лечении БПВП – 22,2, 33,3 и 22,2% соответственно [68]. В проспективном когортном исследовании, выполненном L. Gelinck и соавт. [69], протективный уровень антител в ответ на вакцинацию против гриппа сохранялся у 80% больных, получавших иФНО–α, у 82–93% – прочие БПВП и 89–94% – в здоровом контроле.
В многоцентровом двойном слепом исследовании [70] после назначения противогриппозной вакцины протективный уровень антител у больных РА, получавших адалимумаб, не отличался от такового в плацебо–контроле (98% и 94,55% соответственно). По данным этих же авторов, протективные уровни антител после введения 23–валентной полисахаридной пневмококковой вакцины также были аналогичными в указанных группах (85,9% и 81,7% соответственно). В работе M. Kapetanovic и соавт. [71], включавшей 149 больных РА, максимальный поствакцинальный ответ на пневмококковые антигены 23F и 6B зарегистрирован у пациентов, которым проводилась терапия биологическими агентами (инфликсимаб, этанерцепт), по сравнению с группами, получавшими комбинированное лечение (р=0,037) или МТ в отдельности (р<0,001).
К одной из первых публикаций, посвященных вакцинации у больных РА, получавших лечение РТМ, относится работа голландских исследователей [72]. Основную группу составили 4 больных РА, получившие 2 инфузии РТМ (по 1000 мг в/в с 14–дневным интервалом) на фоне лечения МТ (5–20 мг в неделю). Для сравнения были сформированы 2 группы, сопоставимые по возрасту и полу, которые включали: а)19 больных активным РА, получавших иФНО–α – терапию в сочетании с БПВП или без них; б) 20 здоровых лиц. Иммунизацию трехвалентной противогрипозной вакциной в основной группе осуществляли на 84–й день после первой инфузии РТМ, в группах сравнения – в произвольные сроки. У больных, получавших РТМ, авторы выявили значимое снижение СГТ поствакцинальных антител ко всем трем антигенам, в отличие от обеих групп сравнения (p<0,02 и p<0,001 соответственно). Год спустя в аналогичном исследовании были подтверждены данные о снижении СГТ поствакцинальных антител к вирусу гриппа у больных РА, получавших лечение РТМ [73].
В работе S. van Assen и соавт. [74] представлены данные по иммуногенности и безопасности трехвалентной субъединичной противогриппозной вакцины у 23 больных РА, получавших РТМ, 20 – МТ и 29 здоровых лиц. В РТМ–группе вакцинацию выполняли через 4–8 недель (11 больных – ранняя подгруппа) или спустя 6–10 мес. (12 больных – поздняя подгруппа) после инфузии препарата. СГТ антител ко всем трем штаммам вакцины значимо нарастали как в здоровом контроле, так и в группе МТ, и практически не менялись при РТМ–лечении. Фактор конверсии (кратность увеличения СГТ) также был достоверно большим в здоровом контроле (р=0,001 для A/H1N1–штамма и р=0,03 для В–штамма) и МТ–группе (p<0,001 для штаммов A/H3N2 и A/H1N1) по сравнению с РТМ.
Примечательно, что в РТМ–группе среди больных, которые были вакцинированы от гриппа в течение года, предшествовавшего включению в настоящее исследование, уровень поствакцинального ответа для A/H1N1–штамма был значимо более высоким, по сравнению с невакцинированными пациентами (p=0,007).
Обращает на себя внимание тот факт, что в поздней подгруппе больных, получавших РТМ, наблюдался достоверный рост поствакцинальных уровней СГТ (р=0,04 для A/H3N2–штамма, р=0,003 для A/H1N1–штамма и р=0,007 для В–штамма) и значимое нарастание показателей фактора конверсии ((р=0,041 для A/H3N2–штамма, р=0,043 для A/H1N1–штамма) по сравнению с ранней подгруппой. Данное обстоятельство в определенной степени указывает на вероятность восстановления гуморального иммунного ответа спустя 6–10 мес. после РТМ–лечения.
Показатели серопротекции в РТМ–группе по сравнению с другими испытуемыми были достоверно более низкими для всех трех штаммов противогриппозной вакцины.
Учитывая вышеизложенное, авторы делают вывод о целесообразности ежегодной вакцинации больных РА против гриппа. При этом иммунизация противогриппозной вакциной должна проводиться до начала планируемой РТМ–терапии.
В многоцентровом контролируемом сравнительном исследовании сопоставляли иммуногенность и безопасность столбнячного анатоксина (Т–клеточнозависимый антиген) и 23–валентной пневмококковой полисахаридной вакцины (Т–независимый антиген) у больных РА, получавших РТМ в сочетании с МТ или МТ в отдельности (контрольная группа). Иммунизацию вышеуказанными вакцинами выполняли через 24 и 28 недель соответственно от начала РТМ–лечения. Ответ на противостолбнячную вакцину был аналогичным в обеих группах. Однако доля больных с поствакцинальным ответом к каждому из 12 пневмококковых серотипов через 4 недели после иммунизации была существенно снижена в РТМ–группе. У этих больных также были снижены поствакцинальный ответ на определенное количество серотипов пневмококка и постиммунизационные СГТ антипневмококкового IgG по сравнению с пациентами, получавшими МТ в отдельности. Случаев обострения РА или развития серьезных инфекций не наблюдали. Подчеркивается, что у больных РА, получающих РТМ–лечение, иммунизация пневмококковой вакциной является безопасной, но для повышения поствакцинального ответа она должна быть выполнена до начала анти–В–клеточной терапии [75].
В 2011 г. Европейская антиревматическая лига (EULAR) опубликовала рекомендации по вакцинации больных с аутоиммунными воспалительными РЗ (АВРЗ), основанные на результатах клинических исследований и мнении экспертов [76]. В преамбуле подчеркивается, что под эффективностью вакцины подразумевают способность последней формировать или потенцировать протективный иммунный ответ макроорганизма. Однако, как признают авторы, иммунный ответ in vitro не всегда коррелирует с истинной клинической эффективностью, что необходимо принимать во внимание при интерпретации литературных данных.
Основные положения упомянутых рекомендаций представлены ниже.
1. На начальном этапе обследования больного с АВРЗ выясняют, получал ли пациент какие–либо вакцины в прошлом с акцентом на иммунизацию против Haemophilus influenzae b, гепатитов А и В, вируса папилломы человека, гриппа, менингита, краснухи, пневмококковой инфекции и столбняка.
2. Учитывая теоретический риск обострения АВРЗ после вакцинации, последнюю рекомендуют выполнять при неактивной фазе болезни.
3. Применение живых аттенуированных вакцин (против полиомиелита, желтой лихорадки и др.) у больных с выраженной иммуносупрессией противопоказано, поскольку оно может привести к развитию тяжелой инфекции.
4. По мнению ряда авторов [77–79], для достижения оптимального иммунного ответа у больных АВРЗ вакцинацию следует проводить до назначения ГИБП. Эксперты EULAR считают возможным назначение вакцинации на фоне как БПВП–, так и иФНО–α–терапии. В то же время, как указывалось выше, больным АВРЗ, которым планируется РТМ–терапия, вакцинация должна быть назначена до начала лечения. Если же такое лечение уже проводится, то вакцинацию необходимо выполнить, как минимум, через 6 мес. после начала анти–В–клеточной терапии, но не менее чем за 4 нед. до следующего курса.
5–6. Иммунизация пневмококковой и противогриппозной вакцинами настоятельно рекомендуется больным АВРЗ, поскольку среди них риск летальных исходов от инфекций дыхательных путей достаточно высок.
7. Больные с АВРЗ должны быть вакцинированы столбнячным анатоксином в соответствии с общими рекомендациями. При наличии обширных и/или контаминированных ран у больных, получавших РТМ в течение последних 24 недель, следует выполнить пассивную иммунизацию противостолбнячной сывороткой.
8. Herpes zoster– вакцинация целесообразна только у больных АВРЗ, у которых определяются антитела к данному возбудителю (для исключения первичного заражения).
9. Вакцинация против вируса папилломы человека рекомендуется для женщин – больных СКВ вплоть до 25–летнего возраста.
10. Учитывая высокую летальность (до 70%) при синдроме непреодолимой постспленэктомической инфекции, больным с АВРЗ и гипоспленией/аспленией рекомендуются противогриппозная, пневмококковая, H. influenzae b и менингококковая С – вакцинации.
11. Вакцинация против гепатита А и/или В показана больным АВРЗ только при нарастании риска заражения этими инфекциями (путешествие или проживание в эндемичных районах или повышенный риск контакта/верифицированный контакт с больным гепатитом А и/или В) или при отсутствии протективного уровня антител к ним в макроорганизме.
12. Иммунизация больных АВРЗ против инфекций, связанных с путешествиями, проводится по общим правилам (за исключением живых аттенуированнх вакцин).
13. BCG–вакцинация при АВРЗ не рекомендуется, поскольку она не предотвращает реактивацию существующей латентной туберкулезной инфекции. Описаны случаи BCG–ита у больных с иммунологическими нарушениями.
Рабочей группой EULAR также предложен план дальнейших исследований по рассматриваемой проблеме, который включает создание регистров вакцинированных больных АВРЗ с фокусом на безопасность и эффективность вакцинации, проведение проспективных работ по изучению распространенности и этиологии инфекций у этих пациентов, исследование влияния новых методов лечения на распространенность инфекций, профилактируемых вакцинами и т.д. Подчеркивается важность разработки и внедрения в практику различных схем антибиотикопрофилактики, направленной на дальнейшее снижение обусловленных инфекцией морбидности и летальности у больных АВРЗ.
Таким образом, «…вакцинация является мощным методом профилактики инфекционных заболеваний – важной проблемы для больных РЗ… Вакцину следует применять даже в случаях с ожидаемым субоптимальным ответом» [78]. В целях отработки более четких показаний для вакцинации и оценки влияния на ее результаты различных антиревматических препаратов, необходимы дальнейшие многоцентровые крупномасштабные исследования, в т.ч. в российской популяции пациентов с РЗ.
1 Показатель сероконверсии определяется как: а) доля больных (в %) с 4–кратным по сравнению с исходным нарастанием титров антител к гемагглютинину вируса гриппа после вакцинации или б) доля больных (в %) с титром после вакцинации >1:40 среди имевших исходный титр < 1:10. В соответствии с требованиями Европейской комиссии к противогриппозным вакцинам частота сероконверсии должна составлять >40% или >30% для лиц в возрасте 18–60 лет или старше 60 лет соответственно

| <== предыдущая лекция | | | следующая лекция ==> |
| чень важно длЯ безопасности и сохранениЯ здоровьЯ ‚ашего животного | | | Ирина Анатольевна, давайте начнём с самого начала. Что такое грипп, и каковы могут быть осложнения после перенесённого гриппа? |
Не нашли, что искали? Воспользуйтесь поиском: