
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Кристаллическое строение неметаллов-простых веществ. Аллотропия
Лекция 8
"Неметаллы"
I. Элементы. Неметаллы образуют p -элементы, а также водород и гелий, являющиеся s -элементами. В длиннопериодной таблице p -элементы, образующие неметаллы, располагаются правее и выше условной границы B - At. Атомы неметаллов маленькие (орбитальный радиус меньше 0,1 нм). У большинства из них от четырех до восьми валентных электронов (они же внешние), но у атома водорода - один, у атома гелия - два, а у атома бора - три валентных электрона.
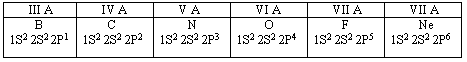
II. Атомы неметаллов сравнительно легко присоединяют чужие электроны (но не более трех). Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства. Самым электроотрицательным является фтор. Склонностью отдавать электроны атомы неметаллов не обладают. У атомов элементов-неметаллов в периоде с увеличением порядкового номера
- заряд ядра увеличивается;
- радиусы атомов уменьшаются;
- число электронов на внешнем слое увеличивается;
- число валентных электронов увеличивается;
- электроотрицательность увеличивается;
- окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).
У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице - в группе) с увеличением порядкового номера
- заряд ядра увеличивается;
- радиус атома увеличивается;
- электроотрицательность уменьшается;
- число валентных электронов не изменяется;
- число внешних электронов не изменяется (за исключением водорода и гелия);
- окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).
III. Простые вещества. Физические свойства. Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет. Молекулярные неметаллы: H2, N2, P4 (белый фосфор), As4, O2, O3, S8, F2, Cl2, Br2, I2. К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы "одноатомными молекулами". При комнатной температуре водород, азот, кислород, озон, фтор и хлор - газы; бром - жидкость; фосфор, мышьяк, сера и йод - твердые вещества. Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами. Итак, физические свойства неметаллов:
1. Ковкость отсутствует
2. Блеска нет
3. Теплопроводность (только графит)
4. Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
5. Электропроводность (только графит и черный Фосфор.)
6. Агрегатное состояние:
o газообразное(H2, O2, Cl2,F2, O3)
o твердое (Р, С)
o жидкое (Br2)
Кристаллическое строение неметаллов-простых веществ. Аллотропия
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
- газы – H2, O2, O3, N2, F2, Cl2;
- жидкость – Br2;
- твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
· Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
· 
IV. Химические свойства. Характерными для большинства неметаллов являются окислительные свойства. Как окислители они реагируют с металлами:
| Ca + Cl2 = CaCl2 | 4Li + O2 = 2Li2O | 2Na + S = Na2S |
с менее электротрицательными неметаллами:
| H2 + S = H2S | P4 + 5O2 = 2P2O5 | 2P + 5Cl2 = 2PCl5 |
со сложными веществами:
| 2FeCl2 + Cl2 = 2FeCl3 | CH4 + Br2 = CH3Br + HBr |
Менее характерны для неметаллов восстановительные свойства. Как восстановители они реагируют с более электротрицательными неметаллами:
| Si + 2F2 = SiF4 | C + O2 = CO2 | C + 2S = CS2 |
со сложными веществами:
| H2 + HCHO = CH3OH | 6P + 5KClO3 = 5KCl + 3P2O5 |
| Cl2 + 2KOH = KClO + KCl + H2O | |
Все неметаллы (кроме элементов благородных газов) образуют молекулярные водородные соединения, причем углерод и бор - очень много. Простейшие водородные соединения:
| B2H6 диборан | CH4 метан | NH3 аммиак | H2O вода | HF фтороводород |
| SiH4 силан | PH3 фосфин | H2S сероводород | HCl хлороводород | |
| GeH4 герман | AsH3 арсин | H2Se селеноводород | HBr бромоводород | |
| H2Te теллуроводород | HI йодоводород |
Все они – газы, за исключением воды. Вещества, выделенные жирным шрифтом, в водном растворе - сильные кислоты. В группе с увеличением порядкового номера их устойчивость снижается, а восстановительная активность возрастает. В периоде с увеличением порядкового номера усиливаются кислотные свойства их растворов, в группе эти свойства ослабевают.
Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.

2) Соединения, разлагаемые водой:
BH3 + 3H2O = H3BO3 + 3H2↑
3) Летучие водородные соединения CH4, PH3, которые не взаимодействуют с водой.
V. Оксиды и гидроксиды. Все оксиды неметаллов относятся к кислотным или несолеобразующим. Несолеобразующие оксиды: CO, SiO, N2O, NO.
Высшим оксидам неметаллов соответствуют следующие кислоты (сильные кислоты выделены жирным шрифтом)
| H3BO3 борная кислота | H2CO3 угольная кислота | HNO3 азотная кислота | - | - |
| H2SiO3 кремниевая кислота | H3PO4 ортофосфорная кислота | H2SO4 серная кислота | HClO4 хлорная кислота | |
| H3AsO4 мышьяковая кислота | H2SeO4 селеновая кислота | HBrO4 бромная кислота | ||
| H6TeO6 ортотеллуровая кислота | HIO4 йодная кислота |
В периоде с возрастанием порядкового номера сила высших кислот увеличивается. В группах выраженной зависимости нет.
VI. Область применения. Элементы жизни. Рождающие руды. Главные элементы Земли и космоса.
| <== предыдущая лекция | | | следующая лекция ==> |
| | | Лабораторная работа № 1. Исследование полупроводниковых схем выпрямителей |
Не нашли, что искали? Воспользуйтесь поиском: