
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Получение галогенов
1. Важнейший способ получения фтора — электролиз расплавов фторидов, где фтор выделяется на аноде:
2F--2e-F2
В качестве основного источника получения используется гидрофторид KHF2.
2. Хлор в лабораторных условиях получают из соляной кислоты при взаимодействии ее с оксидом марганца (IV). Реакция прорекает при нагревании.
+Mn+2Сl2+2Н2O4HСl-1+Mn+4O2=Сl02
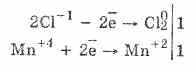
Вместо окислителя MnO2 можно применить перманганат калия KMnO4. Тогда реакция протекает при обычной температуре,
16НСl-1+2KMn+7O4=5Сl02+2Mn+2Сl2+2КСl+8Н2О
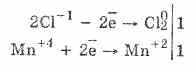
В промышленности хлор получают электролизом раствора хлорида натрия. Газообразный хлор выделяется на аноде:
2NaCl+2Н2O электролиз2NaOH+H2+Cl2
3. Для получения брома чаще применяют реакцию замещения его в бромидах. 2KBr+Сl2=2KСl+Br2
4. Основные источники получения иода — это морские водоросли и нефтяные буровые воды.
2NaI+MnO2+3H2SO4=I2+2NaHSO4+MnSO4+2Н2О Получение иода из его природных источников сводится к переводу его в молекулярный:
2NaI+2NaNO2+2H2SO4=I2+2H2O+2NO+2Na2SO4
5. В лабораторных условиях бром и иод получают одним и тем же способом: действием оксида марганца (IV) на бромиды или иодиды в кислой среде, например:
MnO2+2KBr+2H2SO4=MnSO4+Br2+K2SO4+2Н2О
Физические свойства галогенов
С увеличением заряда ядра от фтора к иоду возрастают температура плавления, кипения (см. табл. 15), электрическая проводимость. Галогены обладают резким запахом и ядовиты. Плохо растворяются в полярных растворителях, хорошо в органических растворителях (спирт, бензол).
Хлор — ядовитый газ желто-зеленого цвета с резким запахом. Тяжелее воздуха в 2,5 раза. Хлор вызывает раздражение дыхательных путей, а вдыхание большого его количества вызывает смерть от удушья. В природном хлоре содержится два изотопа — 3517Сl (75,53%) и 3717Сl (24,47%).
Фтор ядовит чрезвычайно. Бром — тяжелая красно-бурая жидкость. Пары брома ядовиты. При попадании на кожу вызывает сильные ожоги. Иод — черно-фиолетовое твердое вещество При нагревании образуются фиолетовые пары, которые при охлаждении снова превращаются в кристаллы. Происходит возгонка иода, т.е. испарение твердого вещества и образование кристаллов из паров, минуя жидкое состояние.
Таблица 15. Свойства простых веществ подгруппы галогенов

Не нашли, что искали? Воспользуйтесь поиском: