
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Контрольные задания. 1.Сущность первого начала термодинамики
Вариант 1
1.Сущность первого начала термодинамики. Понятие энтальпии. Для придания изделиям из пресного теста пористости, рассыпчатости в качестве разрыхлителя используют гидрокарбонат натрия:
2NаНСО3 = Nа2СО3 + СО2 + Н2О
Определить тепловой эффект данной реакции, если стандартные энтальпии образования:
Н° 298 (NaНСО3) = –951,3 кДж/моль
Н° 298 (Na2СО3) = –1135,3 кДж/моль
Н° 298 (СО2) = –393,5 кДж/моль
Н° 298 (Н2О) = –285,8 кДж/моль
2. Опишите получение коллоидных растворов методом диспергирования (механическое, электрическое, ультразвуком).
3. Состав, строение, классификация, свойства белков. Кислотный и ферментативный гидролиз.
Вариант 2
1. Сущность второго начала термодинамики. Понятие энтропии. Вычислить тепловой эффект реакции превращения глюкозы, протекающей в организме:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О
Стандартные энтальпии образования:
Н° 298 (С6Н12О6 + 6О2) = —1273,0 кДж/моль
Н° 298(Н2О) = —285,8 кДж/моль
Н° 298 (СО2) = —393,5 кДж/моль
2. Опишите получение коллоидных растворов методом физической и химической конденсации.
3. Гидролиз крахмала: ферментативный (выпечка хлеба, варка картофеля), кислотный (варка киселей из кислых фруктов, приготовление соусов с добавлением томата, запекание яблок). Декстринизация крахмала при пассеровании муки, при жарке, выпечке и запекании, образование корочки на поверхности кулинарных изделий.
Вариант 3
1. Охарактеризуйте газообразное, жидкое и твёрдое состояние вещества. Какова масса паров ацетона (СН3)2СО, если при 87°С и давлении 0,959 • 105 Па они занимают объём в 500 см3.
2. Опишите получение коллоидных растворов методом пептизации. Напишите формулы мицеллы золя ВаSО4, полученного при взаимодействии Н2SО4 с избытком Ва(NО3)2. Укажите все части мицеллы.
3. Состав и содержание в продуктах питания сахаров: глюкозы, фруктозы, сахарозы, лактозы и мальтозы. Ферментативный гидролиз сахарозы, мальтозы при брожении теста. Кислотный гидролиз сахарозы при варке плодов и ягод.
Вариант 4
1. Значение адсорбции при хранении сырья и продуктов питания: правила товарного соседства, контроль влажности складских помещений.
2. Золь серы был получен добавлением 5 см3 раствора серы в этаноле к дистиллированной воде. Каким методом получен золь? Чем объясняется, что в прошедшем свете золь имеет красновато-оранжевый оттенок, а в отражённом - голубоватый?
3. Состав, строение, классификация, свойства белков. Кислотный и ферментативный гидролиз. Денатурация, её виды, значение.
Вариант 5
1. Осмос и осмотическое давление. Закон Вант-Гоффа, Плазмолиз, плазмоптис и тургор в живых клетках. Значение осмоса в процессах усвоения пищи микроорганизмами при консервировании пищевых продуктов. В концентрированном сахарном растворе с Росм = 3 · 105 Па происходит плазмолиз клеток почти всех микроорганизмов. Определите молярную концентрацию данного раствора при 25°С; объём раствора 2,5 л.
2. При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III). Напишите формулу мицеллы золя и укажите её части.
3. Состав, строение, классификация, свойства белков. Кислотный и ферментативный гидролиз. Денатурация, её виды, значение.
Вариант 6
1. Жидкое состояние вещества. Поверхностное натяжение и методы его определения Поверхностно-активные вещества и их роль в технологии приготовления пищи: эмульгирование, пенообразование. Вычислите поверхностное натяжение раствора этилового спирта при 24°С, если при выпускании из сталагмометра масса 75 капель составила 4,3918 • 10-3 кг, а масса капель воды равна 4 6386 • 10-3 кг.
2. Коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита Изоэлектрическое состояние. Порог коагуляции.
3. Классифицируйте нижеуказанные системы по агрегатному состоянию дисперсной фазы, и дисперсной среды: мыльная пена, взбитый яичный белок, мука, сливочный крем.
Вариант 7
1. Вязкость жидкостей, её зависимость от различных факторов. Влияние вязкости на качество и вкусовые свойства пищевых продуктов: супов, студней, желированных блюд, каш, изделий из теста. Вычислите вязкость оливкового масла при 20°С, если оно протекает через вискозиметр за 5 минут 49 секунд, а для того же объёма воды при тех же условиях требуется 4 секунды. Плотность оливкового масла 914,18 кг/м3, вязкость воды 0,01 Пз [1•10-3кг/м-с].
2. Понятие об агрегативной и кинетической устойчивости коллоидных растворов.
Напишите формулу мицеллы золя АgВr, полученного при взаимодействии АgNО3 с избытком КВr. Укажите все части мицеллы.
3. Строение и свойства жиров. Температура плавления и дымообразования пищевых жиров. Гидролиз под давлением температуры.
Вариант 8
1. Опишите различия между аморфными и кристаллическими веществами. В чем состоит основное различие связей в кристаллах ионного, молекулярного, атомного типа?
2. Диссоциация раствора электролитов. Степень и константа диссоциации. Сильные и слабые электролиты. Напишите выражение константы диссоциации для карбоната аммония, хлорида натрия и масляной кислоты С3Н7СООН.
3. Оптические свойства золей: опалесценция, эффект Фарадея-Тиндаля, окраска. Оптические свойства бульона, чая, вин, молока.
Вариант 9
1. Скорость химической реакции. Влияние природы реагирующих веществ, площади поверхности, температуры и концентрации на скорость реакции. Температурный режим хранения пищевого сырья и продуктов питания. Влияние температуры на скорость биохимических процессов.
Вычислите, во сколько раз возрастает скорость реакции, протекающей в газовой фазе, если повысить температуру от 20 до 50°С. Температурный коэффициент равен 3.
2. Классификация дисперсных систем.
3. Деэмульгирование и его значение.
Опишите свойства и получение порошков, суспензий, паст, применяемых в технологии приготовления пищи.
Вариант 10
1. Катализ и катализаторы. Виды катализаторов. Теории катализа. Напишите выражения для константы равновесия гомогенной системы.
 2NН3 + 3С12 N2 + 6НСl
2NН3 + 3С12 N2 + 6НСl
Как изменится скорость прямой реакции, если концентрацию аммиака увеличить в 2 раза?
2. Сорбция, её виды. Дайте определение адсорбции; её сущность, зависимость от температуры, площади поверхности.
3. Молекулярно-кинетические свойства дисперсных систем: броуновское движение, диффузия, осмотическое давление. Седиментация, центрифугирование.
Вариант 11
1.Сущность первого начала термодинамики. Понятие энтальпии. Для придания изделиям из пресного теста пористости, рассыпчатости в качестве разрыхлителя используют гидрокарбонат натрия:
2NаНСО3 = Nа2СО3 + СО2 + Н2 О
Определить тепловой эффект данной реакции, если стандартные энтальпии образования:
Н° 298 (NaНСО3) = –951,3 кДж/моль
Н° 298 (Na2СО3) = –1135,3 кДж/моль
Н° 298 (СО2) = –393,5 кДж/моль
Н° 298 (Н2О) = –285,8 кДж/моль
2. Опишите получение коллоидных растворов методом диспергирования (механическое, электрическое, ультразвуком).
3. Гидролиз крахмала: ферментативный (выпечка хлеба, варка картофеля), кислотный (варка киселей из кислых фруктов, приготовление соусов с добавлением томата, запекание яблок). Декстринизация крахмала при пассеровании муки, при жарке, выпечке и запекании, образование корочки на поверхности кулинарных изделий.
Вариант 12
1. Сущность второго начала термодинамики. Понятие энтропии. Вычислить тепловой эффект реакции превращения глюкозы, протекающей в организме:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О
Стандартные энтальпии образования:
Н° 298 (С6Н12О6 + 6О2) = –1273,0 кДж/моль
Н° 298(Н2О) = –285,8 кДж/моль
Н° 298 (СО2) = –393,5 кДж/моль
2. Ферменты как катализаторы, условия их действия. Роль ферментов при брожении и выпечке теста, варке картофеля, в пивоварении, квашении капусты, дезагрегации коллагена мяса в глютин. В каком направлении произойдёт смещение равновесия в системе:
СО(г) + 2Н2(г) + СН3ОН(г)
при увеличении концентрации водорода?
3. Деэмульгирование и его значение.
Опишите свойства и получение порошков, суспензий, паст, применяемых в технологии приготовления пищи.
Вариант 13
1. Охарактеризуйте газообразное, жидкое и твёрдое состояние вещества.
2. При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III). Напишите формулу мицеллы золя и укажите её части.
3. Какую эмульсию будет стабилизировать сажа: эмульсию бензола в воде или воды в бензоле? Объясните и покажите на схеме механизм стабилизации.
Вариант 14
1. Удельная адсорбция. Уравнение Фрейндлиха. Изотерма адсорбции. Теория Ленгмюра, её объяснение.
2. Оптические свойства золей: опалесценция, эффект Фарадея-Тиндаля, окраска. Оптические свойства бульона, чая, вин, молока.
3. Представить строение коллоидной частицы, полученной взаимодействием двух электролитов. Определить знак заряда золя. Электролит 1: Na2SO4 (C1 = 0,01 н, V1 = 20 см3), электролит 2: BaCl2 (C1 = 0,2 н, V1 = 15 см3)
Вариант 15
1. Осмос и осмотическое давление. Закон Вант-Гоффа, Плазмолиз, плазмоптис и тургор в живых клетках. Значение осмоса в процессах усвоения пищи микроорганизмами при консервировании пищевых продуктов. В концентрированном сахарном растворе с Росм = 3·105 Па происходит плазмолиз клеток почти всех микроорганизмов. Определите молярную концентрацию данного раствора при 25°С; объём раствора 2,5 л.
2. Адсорбция газов и растворённых веществ твёрдыми адсорбентами. Строение твёрдой поверхности, примеры твёрдых адсорбентов. Зависимость адсорбции от величины поверхности адсорбента, его природы.
3. Классификация дисперсных систем.
Вариант 16
1. Жидкое состояние вещества. Поверхностное натяжение и методы его определения Поверхностно-активные вещества и их роль в технологии приготовления пищи: эмульгирование, пенообразование. Вычислите поверхностное натяжение раствора этилового спирта при 24°С, если при выпускании из сталагмометра масса 75 капель составила 4,3918 • 10-3 кг, а масса капель воды равна 4 6386 • 10-3 кг.
2. Понятие об агрегативной и кинетической устойчивости коллоидных растворов.
Напишите формулу мицеллы золя АgВr, полученного при взаимодействии АgNО3 с избытком КВr. Укажите все части мицеллы.
3. Состав, строение, классификация, свойства белков. Кислотный и ферментативный гидролиз. Денатурация, её виды, значение.
Вариант 17
1. Вязкость жидкостей, её зависимость от различных факторов. Влияние вязкости на качество и вкусовые свойства пищевых продуктов: супов, студней, желированных блюд, каш, изделий из теста. Вычислите вязкость оливкового масла при 20°С, если оно протекает через вискозиметр за 5 минут 49 секунд, а для того же объёма воды при тех же условиях требуется 4 секунды. Плотность оливкового масла 914,18 кг/м3, вязкость воды 0,01 Пз [1•10-3кг/м-с].
2. Коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита Изоэлектрическое состояние. Порог коагуляции.
3. Явление синерезиса в пищевых студнях и факторы, оказывающие влияние на скорость синерезиса. Практическое применение синерезиса.
Вариант 18
1. Опишите различия между аморфными и кристаллическими веществами. Сублимация и её значение в консервировании пищевых продуктов. В чем состоит основное различие связей в кристаллах ионного, молекулярного, атомного типа?
2. Опишите получение коллоидных растворов методом пептизации. Напишите формулы мицеллы золя ВаSО4, полученного при взаимодействии Н2SО4 с избытком Ва(NО3)2. Укажите все части мицеллы.
3. Классифицируйте нижеуказанные системы по агрегатному состоянию дисперсной фазы, и дисперсной среды: мыльная пена, взбитый яичный белок, мука, сливочный крем.
Вариант 19
1. Скорость химической реакции. Влияние природы реагирующих веществ, площади поверхности, температуры и концентрации на скорость реакции. Температурный режим хранения пищевого сырья и продуктов питания. Влияние температуры на скорость биохимических процессов.
Вычислите, во сколько раз возрастает скорость реакции, протекающей в газовой фазе, если повысить температуру от 20 до 50°С. Температурный коэффициент равен 3.
2. Электрокинетические явления коллоидных растворов (электрофорез и электроосмос), их значение. Схема опыта Рейсса.
3. Карамелизация сахарозы. Реакция меланоидинообразия в продуктах растительного и животного происхождения желтоватая окраска бульонов, образование желтовато-коричневой корочки на поверхности продуктов при их запекании. Окраска пенки и топленого молока.
Вариант 20
1. Катализ и катализаторы. Виды катализаторов. Теории катализа. Напишите выражения для константы равновесия гомогенной системы.
 2NН3 + 3С12 N2 + 6НСl
2NН3 + 3С12 N2 + 6НСl
Как изменится скорость прямой реакции, если концентрацию аммиака увеличить в 2 раза?
2. Опишите получение коллоидных растворов методом физической и химической конденсации.
3. Строение и свойства грубодисперсных систем. Пены.
Вариант 21
1. Сущность второго начала термодинамики. Понятие энтропии. Вычислить тепловой эффект реакции превращения глюкозы, протекающей в организме:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О
Стандартные энтальпии образования:
Н° 298 (С6Н12О6 + 6О2) = —1273,0 кДж/моль
Н° 298(Н2О) = —285,8 кДж/моль
Н° 298 (СО2) = —393,5 кДж/моль
2. Опишите получение коллоидных растворов на примере конденсации FeCL3 + H2O.
(изб.)
3. Состав и содержание в продуктах питания сахаров: глюкозы, фруктозы, сахарозы, лактозы и мальтозы. Ферментативный гидролиз сахарозы, мальтозы при брожении теста. Кислотный гидролиз сахарозы при варке плодов и ягод.
Вариант 22
1. Общие свойства пограничных слоев. Термодинамическая характеристика поверхности.
2. Молекулярно-кинетические свойства дисперсных систем: броуновское движение, диффузия, осмотическое давление. Седиментация, центрифугирование.
3. Опишите свойства и получение порошков, суспензий, паст, применяемых в технологии приготовления пищи.
Вариант 23
1. Жидкое состояние вещества. Поверхностное натяжение и методы его определения Поверхностно-активные вещества и их роль в технологии приготовления пищи: эмульгирование, пенообразование. Вычислите поверхностное натяжение раствора этилового спирта при 24°С, если при выпускании из сталагмометра масса 75 капель составила 4,3918 • 10-3 кг, а масса капель воды равна 4 6386 • 10-3 кг.
2. При пропускании избытка сероводорода в подкисленный раствор хлорида мышьяка (III) образовался золь сульфида мышьяка (III). Напишите формулу мицеллы золя и укажите её части.
3. Классифицируйте нижеуказанные системы по агрегатному состоянию дисперсной фазы, и дисперсной среды: мыльная пена, взбитый яичный белок, мука, сливочный крем.
Вариант 24
1. Осмос и осмотическое давление. Закон Вант-Гоффа, Плазмолиз, плазмоптис и тургор в живых клетках. Значение осмоса в процессах усвоения пищи микроорганизмами при консервировании пищевых продуктов. В концентрированном сахарном растворе с Росм = 3·105 Па происходит плазмолиз клеток почти всех микроорганизмов. Определите молярную концентрацию данного раствора при 25°С; объём раствора 2,5 л.
2. Оптические свойства золей: опалесценция, эффект Фарадея-Тиндаля, окраска. Оптические свойства бульона, чая, вин, молока.
3. Какую эмульсию будет стабилизировать сажа: эмульсию бензола в воде или воды в бензоле? Объясните и покажите на схеме механизм стабилизации.
Вариант 25
1. Скорость химической реакции. Влияние природы реагирующих веществ, площади поверхности, температуры и концентрации на скорость реакции. Температурный режим хранения пищевого сырья и продуктов питания. Влияние температуры на скорость биохимических процессов.
Вычислите, во сколько раз возрастает скорость реакции, протекающей в газовой фазе, если повысить температуру от 20 до 50°С. Температурный коэффициент равен 3.
2. Методы исследования дисперсных систем: ультрамикроскопия, нефелометрия.
3. Гидролиз крахмала: ферментативный (выпечка хлеба, варка картофеля), кислотный (варка киселей из кислых фруктов, приготовление соусов с добавлением томата, запекание яблок). Декстринизация крахмала при пассеровании муки, при жарке, выпечке и запекании, образование корочки на поверхности кулинарных изделий.
Вариант 26
1. Вязкость жидкостей, её зависимость от различных факторов. Влияние вязкости на качество и вкусовые свойства пищевых продуктов: супов, студней, желированных блюд, каш, изделий из теста. Вычислите вязкость оливкового масла при 20°С, если оно протекает через вискозиметр за 5 минут 49 секунд, а для того же объёма воды при тех же условиях требуется 4 секунды. Плотность оливкового масла 914,18 кг/м3, вязкость воды 0,01 Пз [1•10-3кг/м-с].
2. Ферменты как катализаторы, условия их действия. Роль ферментов при брожении и выпечке теста, варке картофеля, в пивоварении, квашении капусты, дезагрегации коллагена мяса в глютин. В каком направлении произойдёт смещение равновесия в системе:
СО(г) + 2Н2(г) + СН3ОН(г)
при увеличении концентрации водорода?
3. Понятие об агрегативной и кинетической устойчивости коллоидных растворов.
Напишите формулу мицеллы золя АgВr, полученного при взаимодействии АgNО3 с избытком КВr. Укажите все части мицеллы.
Вариант 27
1. Сущность законов термодинамики. Реальные газы. Критические состояния. Изотерма реального газа. Замораживание пищевых продуктов жидкими газами. Какой объём занимает 1,8 кг паров эфира (С2Н5)2О при 20°С и давлении 0,58•105 Па?
2. Опишите явление адсорбции на поверхности раствор - газ. Теория Ленгмюра.
Значение поверхностно-активных веществ в технологии приготовления пищи (эмульгирование, пенообразование).
3. Коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита Изоэлектрическое состояние. Порог коагуляции.
Вариант 28
1. Охарактеризуйте газообразное, жидкое и твёрдое состояние вещества. Какова масса паров ацетона (СН3)2СО, если при 87°С и давлении 0,959 • 105 Па они занимают объём в 500 см3.
2. Опишите получение коллоидных растворов методом пептизации на примере FeCl3 + K4[Fe(СN)6], пептизатор H2C2O4. Укажите все части мицеллы.
3. Классифицируйте нижеуказанные системы по агрегатному состоянию дисперсной фазы, и дисперсной среды: мыльная пена, взбитый яичный белок, мука, сливочный крем.
Вариант 29
1.Сущность первого начала термодинамики. Понятие энтальпии. Для придания изделиям из пресного теста пористости, рассыпчатости в качестве разрыхлителя используют гидрокарбонат натрия:
2NаНСО3 = Nа2СО3 + СО2 + Н2 О
Определить тепловой эффект данной реакции, если стандартные энтальпии образования:
Н° 298 (NaСО3) = –951,3 кДж/моль
Н° 298 (Na2СО3) = –1135,3 кДж/моль
Н° 298 (СО2) = –393,5 кДж/моль
Н° 298 (Н2О) = –285,8 кДж/моль
2. Сорбция, её виды. Дайте определение адсорбции; её сущность, зависимость от температуры, площади поверхности.
3. Диссоциация раствора электролитов. Степень и константа диссоциации. Сильные и слабые электролиты. Напишите выражение константы диссоциации для карбоната аммония, хлорида натрия и масляной кислоты С3Н7СООН.
Вариант 30
1. Катализ и катализаторы. Виды катализаторов. Теории катализа. Напишите выражения для константы равновесия гомогенной системы.
 2NН3 + 3С12 N2 + 6НСl
2NН3 + 3С12 N2 + 6НСl
Как изменится скорость прямой реакции, если концентрацию аммиака увеличить в 2 раза?
2. Буферные растворы и их значение.
Определите концентрацию ионов гидроксида, величину рН и среду раствора, если концентрация ионов водорода равна:
а) 10-4 моль/л б) 10-9 моль/л
3. Опишите получение коллоидных растворов методом физической и химической конденсации.
Вариант 31
1. Скорость химической реакции. Влияние природы реагирующих веществ, площади поверхности, температуры и концентрации на скорость реакции. Температурный режим хранения пищевого сырья и продуктов питания. Влияние температуры на скорость биохимических процессов.
Вычислите, во сколько раз возрастает скорость реакции, протекающей в газовой фазе, если повысить температуру от 20 до 50°С. Температурный коэффициент равен 3.
2. Очистка золей: диализ, электродиализ, ультрафильтрация, схема и принцип работы прибора диализатора и электродиализатора.
3. Строение и свойства жиров. Температура плавления и дымообразования пищевых жиров. Гидролиз под давлением температуры.
Приложение 1
Таблица 1
Термодинамические константы некоторых веществ
| № п/п | Вещество | ΔН298 кДж/моль | ΔН 298 кДж/моль | S298 кДж/моль∙К |
| 1. | Аg1 (к) | 64,2 | 66,3 | 114,2 |
| 2. | Аg20 (к) | –30,56 | –10,82 | 121,7 |
| 3. | Аl(ОН)3 (к) | –1275,7 | –1139,72 | 71,1 |
| 4. | АlСl3 (к) | –697,4 | –636,8 | –167,0 |
| 5. | С (алмаз) | 1,897 | 2,866 | 2,38 |
| 6. | С (графит) | 5,74 | ||
| 7. | СО (г) | –110, 0 | –137,27 | 197,4 |
| 8. | СО 2 (г) | –393,51 | –394,38 | 213,6 |
| 9. | С2Н2 (г) | 226,75 | 209,2 | 200,8 |
| 10. | С2H4 (г) | 52,28 | 68,12 | 219,4 |
| 11. | С2Нб (г) | –74,85 | –50,79 | 186,19 |
| 12. | СНзОН (ж) | –84,67 | –32,89 | 229,5 |
| 13. | С 2Н5ОН (ж) | –277,7 | –166,31 | 126,7 |
| 14. | СН3СООН (ж) | –487 | —174,77 | 160,7 |
| 15. | С 2 (г) | –484,9 | –392,46 | 159,8 |
| 16. | 223,0 | |||
| 17. | НСl (г) | –92,30 I | –95,27 | 186,7 |
| 18. | НСl (ж) | –167,5 | 131,2 | 55,2 |
| 19. | Н 2О (г) | –241,84 | –228,8 | 188,74 |
| 20. | Н2О (ж) | –285,84 | –237,5 | 69,96 |
| 21. | NНз (г) | –46,19 | –16,64 | 192,5 |
| 22. | NaОН (1с) | –426,6 | 377,0 | 64,18 |
| 23. | 5О2 (г) | –296,9 | –300,37 | 248,1 |
Таблица 2
Теплота сгорания органических соединений в стандартных условиях
(конечные продукты сгорания СО2(г), Н2О (ж))
| Соединение | ΔН° 298 кДж/моль | Соединение | ΔН°298 кДж/моль |
| СН4 (г) | —890,31 | С4Н10О (ж) | —2730,90 |
| С2Н2 (г) | — 1299,63 | Диэтиловый эфир | |
| С2Н4 (г) | — 1410,97 | СН3СООН (ж) | —873,79 |
| С2Н6 (г) | —1559,88 | С6Н12О6 | —2815,8 |
| С6Н6 (ж) | —3267,70 | С12Н12О11 | —5648,0 |
| СН3ОН (ж) | —726,64 | ||
| С2Н5ОН (ж) | —1366,91 | ||
| С3Н5 (ОН)2 (ж) | —1664,40 |
Таблица 3
Криоскопические и эмбулиоскопические константы растворителей
| Растворитель | Кк | Кэ | tпл | tкип |
| Анилин | 5,87 | 3,69 | –5,96 | 184,4 |
| Ацетон | 2,4 | 1,48 | –94,6 | |
| Бензол | 5,12 | 2,57 | 5,4 | 80,2 |
| Вода | 1,86 | 0,52 | ||
| Фенол | 2,27 | 3,6 | 182,1 | |
| Хлороформ | 4,9 | 3,88 | –63,2 | 61,2 |
| Четырёххлористый углерод | 2,98 | 5,3 | –23 | 76,6 |
Таблица 4
Некоторые данные международной системы СИ
| Название величины | Единица измерения и сокращённое обозначение | Переводной коэффициент |
| Длина | метр - м | 1 см = 10-2 м |
| Площадь S | кв. метр - м2 | 1 см 2 = 10-4 м2 |
| Объём V | куб. метр – м3 | 1 см2 = 10-6 м3 1 л =10-3 м3 |
| Время t | секунда - с | |
| Скорость V | метр в секунду - м/с | 1 см/с = 10-2 м/с |
| Масса m | килограмм - кг | 1т = 103; 1г=10-3кг |
| Химическая концентрация М | киломоль - кмоль | 1 моль = 10-3 кмоль |
| Плотность Р | килограмм на куб. метр – кг/м3 | 1г/см3=10-3 кг/м3 |
| Сила I | Ньютон - Н | 1дина=10-5 Н |
| Давление Р | Ньютон на кв. метр - Н/м2(Па) | 1кг = 9,8Н 1атм = 101325Па |
| Работа, энергия A | Джоуль - Дж(Н∙м) | 1л·атм = 1,013∙102Дж |
| Теплота, внутренняя и энергия | Джоуль -Дж | 1эрг = 10 -7Дж 1кал = 4,18Дж 1ккал = 4,19*103Дж |
| Молярная теплота (сгорания), ΔН образования | Джоуль на кило-моль - Дж/кмоль | 1 кал/моль = 4,19∙103 Дж/кмоль 1 ккал/моль = 4,19* 106 Дж/кмоль |
| Молярность См | Кмоль/м3 - кмоль/м3 | 1 моль/л = 1 кмоль/м3 |
| Поверхностное натяжение σ | Ньютон на метр - Дж/м3 = Н/м | 1 эрг/см2 = 1 дин/см = 1дин/см = 10 -3Н/м |
| Вязкость ή | Ньютон в секунду на кв. метр - Н∙с/м2 | 1 Пуаз = 0,1∙с/м2 |
| Количество вещества n | Моль - моль | |
| Температура Т | Кельвин - К | К = С° + 273 |
Таблица 5
Некоторые физические постоянные
| Название величины | Сокращённое обозначение, единицы измерения | Переводной коэффициент |
| Молярная газовая постоянная R | Дж/кмоль • К |  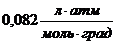
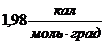 8,31 Дж/моль∙К
8,31 Дж/моль∙К
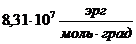

|
| Число Авогадро N |  1
кмоль 1
кмоль
| 6,02∙1023 моль-1 =6,02∙1026 кмоль-1 |
| Объём одного кмоль газа при н.у. | м3 /кмоль | 22,4 л/моль = 22,4∙10–3 м3 /моль |
Вопросы для подготовки к экзамену
1. Физколлоидная химия. Предмет и содержание.
2. Основные положения теории электролитической диссоциации Аррениуса.
3. Активность и коэффициент активности.
4. Теория Дебая и Гюккеля.
5. Сольватация и гидратация ионов.
6. Протолитическая теория кислот и оснований.
7. Электропроводимость растворов. Удельная и эквивалентная проводимость.
8. Закон Кольрауша (Закон независимости движения ионов).
9. Агрегатное состояние вещества.
10. Внутренняя энергия системы.
11. Энтальпия.
12. Экзотермические реакции.
13. Эндотермические реакции.
14. Закон Гесса.
15. Энтальпия сгорания и образования. Свободная энергия Гиббса (изобарно-изотермический потенциал).
16. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действия масс.
17. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Энергия активации.
18. Виды катализа. Гомогенный, гетерогенный, автокатализ.
19. Обратимые и необратимые реакции. Постоянная химического равновесия.
20. Принцип Ле-Шателье.
21. Общая характеристика растворов.
22. Растворы электролитов.
23. Теория электролитической диссоциации.
24. Факторы, влияющие на скорость химической реакции.
25. Осмос.
26. Диффузия.
27. Физическая адсорбция.
28. Хемосорбция.
29. Адсорбция из растворов.
30. Коллоидная химия. Предмет и содержание.
31. Классификация дисперсных систем.
32. Строение мицеллы. Получение коллоидных растворов.
33. Свойства коллоидных растворов (оптические, молекулярно-кинетические, электрокинетические).
34. Стабилизация и коагуляция дисперсных систем.
35. Коллоидные поверхностно-активные вещества. Моющее действие мыл. Солюбилизация.
36. Грубодисперсные системы. Эмульсии. Пены. Порошки. Взвеси. Аэрозоли. Их строение, получение и использование в пищевой промышленности.
37. Высокомолекулярные соединения. Свойства ВМС.
38. ВМС. Белки. Строение, свойства, пищевая ценность. Обмен в организме.
39. ВМС. Углеводы. Монозы, дисахариды, полисахариды. Строение, свойства. Пищевая ценность. Обмен в организме.
40. Жиры, строение, свойства. Пищевая ценность. Обмен в организме.
Не нашли, что искали? Воспользуйтесь поиском: