
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электролиты. Электролиз
 Вещества, раствор которых в воде и некоторых других диэлектрических жидкостях проводит электрический ток, называются электролитами. Молекулы электролита и растворителя являются дипольными. Поэтому в растворе каждую молекулу окружает группа молекул растворителя (см. рис. слева). Очевидно, что молекулы растворителя стремятся как бы разорвать молекулу электролита на две части; этому способствует также тепловое движение – колебание молекул в атоме электролита. В результате большинство молекул электролита распадается на положительные ионы (катионы) и отрицательные ионы (анионы).
Вещества, раствор которых в воде и некоторых других диэлектрических жидкостях проводит электрический ток, называются электролитами. Молекулы электролита и растворителя являются дипольными. Поэтому в растворе каждую молекулу окружает группа молекул растворителя (см. рис. слева). Очевидно, что молекулы растворителя стремятся как бы разорвать молекулу электролита на две части; этому способствует также тепловое движение – колебание молекул в атоме электролита. В результате большинство молекул электролита распадается на положительные ионы (катионы) и отрицательные ионы (анионы).
Описанный процесс называется электролитической диссоциацией. Обратному процессу – воссоединению (рекомбинации) ионов электролита в нейтральные молекулы – препятствует образующаяся на иона сольватная оболочка, состоящая из молекул растворителя (см. рис. справа). Степенью или коэффициентом диссоциации называется отношение числа диссоциированных молекул электролита к общему числу его молекул:
 .
.
Степень диссоциации зависит от природы электролита и растворителя, концентрации электролита  и температуры. В слабых растворах (
и температуры. В слабых растворах (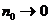 ) почти все молекулы электролита диссоциированы (
) почти все молекулы электролита диссоциированы ( ), с повышением концентрации степень диссоциации уменьшается.
), с повышением концентрации степень диссоциации уменьшается.
При отсутствии электрического поля ионы электролита вместе со своими сольватными оболочками движутся хаотически. При наличии поля их движение упорядочивается: катионы движутся по полю, анионы – против поля. В жидкости возникает электрический ток, обусловленный встречным движением разноимённых ионов. Такого рода проводимость называется ионной.
Кроме указанных растворов ионной проводимостью обладают расплавы солей и окислов металлов: они также относятся к группе электролитов.
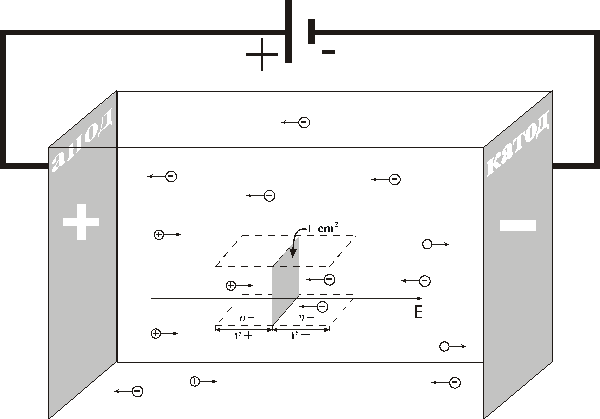
Определим плотность тока 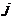 в жидкости, т. е. заряд, переносимый за 1 с через воображаемую площадку в
в жидкости, т. е. заряд, переносимый за 1 с через воображаемую площадку в  , перпендикулярную направлению движению ионов (рис. ниже).
, перпендикулярную направлению движению ионов (рис. ниже).
Так как перенос заряда осуществляется ионами обоих знаков, то
 ,
,
где 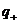 и
и  - заряды обоих катионов и анионов,
- заряды обоих катионов и анионов, 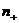 и
и 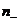 - концентрации этих ионов,
- концентрации этих ионов, 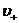 и
и 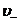 - средние скорости упорядоченного движения этих ионов.
- средние скорости упорядоченного движения этих ионов.
Учитывая, что раствор в целом нейтрален, можем написать:
 , (1)
, (1)
где  - заряд иона любого знака,
- заряд иона любого знака, 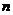 - концентрация ионов этого же знака. Заряд иона обусловлен потерей (для катиона) или сохранением (для аниона) валентных электронов при диссоциации молекулы. Поэтому, обозначив валентность электрона через
- концентрация ионов этого же знака. Заряд иона обусловлен потерей (для катиона) или сохранением (для аниона) валентных электронов при диссоциации молекулы. Поэтому, обозначив валентность электрона через 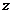 найдём
найдём
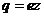 , (2)
, (2)
где  - абсолютное значение заряда электрона. Тогда, учитывая формулы (1) и (2), получим
- абсолютное значение заряда электрона. Тогда, учитывая формулы (1) и (2), получим
 .
.
В электрическом поле на движение иона оказывают влияние две силы: во-первых ускоряющая электрическая сила
 ,
,
где  - напряжённость поля; во-вторых, тормозящая сила
- напряжённость поля; во-вторых, тормозящая сила
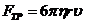 ,
,
где 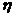 - вязкость жидкости. При установившемся движении жидкости (которое наступает практически одновременно с появлением поля)
- вязкость жидкости. При установившемся движении жидкости (которое наступает практически одновременно с появлением поля) 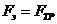 , тогда
, тогда
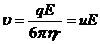 , (3)
, (3)
где 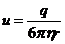 - подвижность иона. Из формулы (3) следует, что
- подвижность иона. Из формулы (3) следует, что  при
при 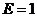 . Таким образом подвижность иона равна скорости равномерного движения этого иона под действием электрического поля единичной напряжённости.
. Таким образом подвижность иона равна скорости равномерного движения этого иона под действием электрического поля единичной напряжённости.
Учитывая формулу (3), запишем выражения для плотности тока в виде
 , (4)
, (4)
или
 , (5)
, (5)
где
 (6)
(6)
- удельная электропроводность жидкости. Таким образом, выражения (4) и (5) представляют собой закон Ома в дифференциальной форме для жидкости. Величина
 (7)
(7)
является удельным сопротивлением жидкости. Так как с повышением температуры подвижность  и концентрация
и концентрация 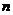 возрастают, то, согласно формуле (7), с повышением температуры сопротивление жидкости уменьшается.
возрастают, то, согласно формуле (7), с повышением температуры сопротивление жидкости уменьшается.
Подходя к электродам, ионы электролита нейтрализуются и оседают на электродах или же выделяются около электродов в виде газа (первичная реакция). Зачастую нейтрализовавшиеся ионы вновь вступают в реакцию с растворителем, образуя новые ионы, которые затем оседают на электродах (вторичная реакция).
Выделение на электродах продуктов разложения раствора электролита при прохождении через этот раствор тока называется электролизом.
Законы Фарадея
Количественные закономерности электролита установил английский физик М. Фарадей. Эти закономерности нетрудно вывести теоретически на основе представления об ионной проводимости.
Если за время 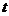 у электрода нейтрализуется
у электрода нейтрализуется 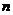 ионов, каждый из которых имеет валентность
ионов, каждый из которых имеет валентность 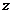 и массу
и массу  , то электрод получит заряд
, то электрод получит заряд
 ,
,
где  - заряд электрона. При этом на электроде осядет масса вещества
- заряд электрона. При этом на электроде осядет масса вещества 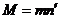 .
.
Отношение
 (8)
(8)
есть постоянная для данного вещества величина, называемая электрохимическим эквивалентом этого вещества. Очевидно, что электрохимический эквивалент равен количеству вещества, выделяющегося на электроде при прохождении через раствор единицы количества электричества. Из формулы (8) следует, что
 ,
,
где 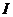 - сила тока, протекающего через раствор.
- сила тока, протекающего через раствор.
Первый закон Фарадея. Масса вещества, выделяющегося на электроде пропорциональна количеству электричества, прошедшего через раствор.
Умножим и разделим (8) на постоянную Авогадро  :
:
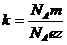 .
.
Учитывая, что 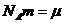 - молярная масса вещества, получим
- молярная масса вещества, получим
 ,
,
где

- универсальная постоянная, называемая постоянной Фарадея. Отношение 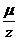 называется химическим эквивалентом вещества.
называется химическим эквивалентом вещества.
Второй закон Фарадея. Электрохимический эквивалент вещества пропорционален его химическому эквиваленту.
Объединив оба закона Фарадея, получим
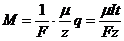 ,
,
откуда следует, что 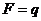 при
при  , т. е. постоянная Фарадея равна количеству электричества, при прохождении которого через раствор на каждом из электродов выделяется количество вещества, равное химическому эквиваленту.
, т. е. постоянная Фарадея равна количеству электричества, при прохождении которого через раствор на каждом из электродов выделяется количество вещества, равное химическому эквиваленту.
Согласно опытным данным,
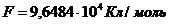 .
.
Не нашли, что искали? Воспользуйтесь поиском: