
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электролиз. Применение электролиза в технике.
Чистая дистиллированная вода – это хороший диэлектрик. Раствор кислоты в воде – хороший проводник. Диполи воды, возникающие в результате действия электрического поля, окружают молекулу кислоты и «растаскивают» ее на ионы (рис.21).
Распад молекул на ионы под действием растворителя называют электролитической диссоциацией. 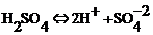
|
Рисунок 21. Электролитическая диссоциация
Рассмотрим процесс прохождения электрического тока в электролите. В электролитическую ванну налит раствор серной кислоты и опущены две платиновых пластины. Пластины называются электродами. Электрод, соединенный с (+) источника тока, называется анодом. Э лектрод, соединенный с (-) источника тока, называется катодом.
В результате электролитической диссоциации в растворе образуются ионы:

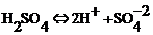
Процессы на катодеПроцессы на аноде
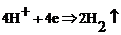

Здесь  заряд электрона. На катоде выделяется газообразный водород, а на аноде – газообразный кислород. Из раствора уходят части молекул воды, а составные части кислоты остаются в растворе. Прохождение электрического тока через электролиты, сопровождающееся химическими превращениями вещества и выделением его на электродах, называется электролизом. В рассмотренном примере выделение вещества происходит при неактивном аноде, то есть анод выполнен из платины и не растворяется в электролите.
заряд электрона. На катоде выделяется газообразный водород, а на аноде – газообразный кислород. Из раствора уходят части молекул воды, а составные части кислоты остаются в растворе. Прохождение электрического тока через электролиты, сопровождающееся химическими превращениями вещества и выделением его на электродах, называется электролизом. В рассмотренном примере выделение вещества происходит при неактивном аноде, то есть анод выполнен из платины и не растворяется в электролите.
Если в электролитическую ванну налить раствор соли того же вещества, из которого сделан анод, то в процессе электролиза вещество выделится на катоде, а анод растворится. В этом случае анод называют активным, так как он реагирует с электролитом. Таким способом выделяют химически чистые металлы, например медь, серебро (рисунок 22) и т.д.
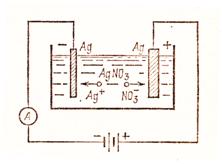 Электролиз применяется также для нанесения слоя одного металла на поверхность другого металла и для электрополировки поверхности металлов.
Электролиз применяется также для нанесения слоя одного металла на поверхность другого металла и для электрополировки поверхности металлов.
Ток в электролите подчиняется закону Ома.
|
Законы электролиза (законы Фарадея)
1-й закон Фарадея: Масса вещества  , выделяющегося при электролизе, прямо пропорциональна количеству электричества
, выделяющегося при электролизе, прямо пропорциональна количеству электричества  , прошедшего через раствор.
, прошедшего через раствор. 
Коэффициент пропорциональности  называют электрохимическим эквивалентом вещества. Поскольку
называют электрохимическим эквивалентом вещества. Поскольку 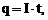 то
то  .
.
Не нашли, что искали? Воспользуйтесь поиском:
