
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
При электролизе раствора соли
| На аноде разряжается: 1) кислотный остаток(An) 2) кислород из воды | Кислотный остаток- анион: а) карбонат б) хлорид в)нитрат г)сульфат д) бромид е) иодид |
Выберите правильный вариант.
91. Из смеси катионов: Ag+, Cu2+, Fe2+, Zn2+ в первую очередь восстановятся катионы:
| 1.меди 2.железа | 3.цинка 4.серебра |
92. Для покрытия металла никелем электролиз ведут, используя:
| 1.К - никелевый 2.А - никелевый | 3.К - угольный 4.А - угольный |
93. При электролизе раствора хлорида натрия среда раствора у катода:
1) кислая
2) нейтральная
3) щелочная
94. Кальций можно получить из хлорида кальция путем:
1) электролиза раствора
2) электролиза расплава
3) восстановлением водорода
4) термического разложения.
95. При электролизе раствора хлорида меди (анод медный) на аноде окислится:
1) хлор
2) кислород
3) водород
4) медь
96. При электролизе раствора карбоната натрия с графитовыми электродами на аноде происходит:
1) выделение СО2
2) выделение кислорода
3) выделение водорода
4) осаждение натрия.
Часть В
Дайте полное решение заданий.
Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер.
2. Если в момент химического равновесия 2NO + O2 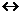 2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
1) 12 моль/л и 8 моль/л;
2) 14 моль/л и 8 моль/л;
3) 16 моль/л и 12 моль/л;
4) 32 моль/л и 24 моль/л.
3. Окисление аммиака протекает по уравнению: 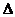 Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O
Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O 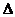 Н x.p. = -1528 кДж
Н x.p. = -1528 кДж
кДж/моль г г г ж (-285,84)
теплота образования аммиака (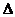 Н0 обр.(NH3)) равна:
Н0 обр.(NH3)) равна:
1) -92,15 кДж/моль;
2) 92,15 кДж/моль;
3) 46,76 кДж/моль;
4) -46,76 кДж/моль.
Не нашли, что искали? Воспользуйтесь поиском: