
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретическая часть. Определение удельной и молярной теплоты парообразования воды при фазовом переходе первого рода по экспериментально полученной зависимости давления насыщенных
Цель работы
Определение удельной и молярной теплоты парообразования воды при фазовом переходе первого рода по экспериментально полученной зависимости давления насыщенных паров от температуры.
Теоретическая часть
Фазой называется термодинамически равновесное состояние вещества, имеющая границу с другими частями системы, в которой она находится, и отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Фазовый переход первого рода всегда сопровождается поглощением или выделением скрытой теплоты Q и изменением удельного объема  и молярного объема μ υ вещества, μ υ =
и молярного объема μ υ вещества, μ υ =  , где
, где  – число молей;
– число молей;  , m – масса, μ – молярная масса вещества.
, m – масса, μ – молярная масса вещества.
Поскольку количество скрытой теплоты зависит от массы вещества, претерпевающей фазовый переход, для характеристики процесса используется удельная теплота перехода q, отнесенная к единице массы вещества:
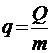 , (2.1)
, (2.1)
и молярная теплота перехода μ q, отнесенная к одному молю вещества:
 . (2.2)
. (2.2)
При постоянном давлении фазовый переход всегда проходит при определенной температуре, называемой температурой перехода, при которой возможно термодинамическое равновесие фаз при данном давлении. Для рассмотрения фазового перехода «жидкость – пар» обратимся к изотермам, построенным для нескольких значений температуры (Т 1, Т 2) на P – V диаграмме рис.2.1.

Рис.2.1. Изотермы Ван-дер-Ваальса и реального вещества
Горизонтальные участки изотерм отвечают областям фазового перехода. В процессе перехода молярный объем скачкообразно изменяется от величины  , что соответствует молярному объему жидкой фазы, до величины
, что соответствует молярному объему жидкой фазы, до величины  , что соответствует молярному объему газообразной фазы. Любая точка с координатами p и
, что соответствует молярному объему газообразной фазы. Любая точка с координатами p и  , находящаяся справа от кривой EDB, соответствует газообразному состоянию. Любая другая точка с координатами p' и
, находящаяся справа от кривой EDB, соответствует газообразному состоянию. Любая другая точка с координатами p' и  , расположенная слева от кривой ECA, соответствует жидкому состоянию вещества. Все точки, лежащие внутри кривой ACEDB, соответствуют двухфазным состояниям, т.е. состояниям, при которых одновременно существует жидкость и насыщенный пар над ней. Интервал
, расположенная слева от кривой ECA, соответствует жидкому состоянию вещества. Все точки, лежащие внутри кривой ACEDB, соответствуют двухфазным состояниям, т.е. состояниям, при которых одновременно существует жидкость и насыщенный пар над ней. Интервал  –
–  представляет собой область двухфазного состояния (жидкость – пар) вещества. Среди всех возможностей температур есть одна, называемая критической температурой Т кр, при которой горизонтальный участок изотермы, что отвечает фазовому переходу, вырождается в точку перегиба (точка E на рис.2.1). При температуре вещества, больше критической, исчезает разница между паром и жидкостью, а вещество ни при каком давлении невозможно перевести из газообразного в жидкое состояние. За областью фазового перехода состояние реального вещества в жидкой и газообразной фазах достаточно точно описывает уравнение Ван-дер-Ваальса, которое для одного моля газа имеет вид
представляет собой область двухфазного состояния (жидкость – пар) вещества. Среди всех возможностей температур есть одна, называемая критической температурой Т кр, при которой горизонтальный участок изотермы, что отвечает фазовому переходу, вырождается в точку перегиба (точка E на рис.2.1). При температуре вещества, больше критической, исчезает разница между паром и жидкостью, а вещество ни при каком давлении невозможно перевести из газообразного в жидкое состояние. За областью фазового перехода состояние реального вещества в жидкой и газообразной фазах достаточно точно описывает уравнение Ван-дер-Ваальса, которое для одного моля газа имеет вид
 (2.3)
(2.3)
где а и b введены для учета потенциального взаимодействия между молекулами и собственного объема газа. Изотерма, описываемая уравнением Ван-дер-Ваальса на P – V диаграмме для температуры Т 1, изображена на рис.2.1 штрихпунктирной линией.
Для вычисления изменения давления насыщенного пара в зависимости от температуры проведем для одного моля вещества цикл Карно, в который входят горизонтальные участки изотерм реального вещества АВ и СD (рис.1). Пусть Р 1= Р; Р 2= Р + dР; Т 1= Т; Т 2= Т + dТ. Выполненная за цикл работа δ А равна площади этого цикла на P – V диаграмме, а сам цикл, учитывая близость изотерм его образующих, можно приближенно считать параллелограммом.
Тогда
 . (2.4)
. (2.4)
В ходе изотермического фазового перехода (участок АВ) вещество получает от нагревателя количество теплоты, равное молярной теплоте перехода  . Поэтому КПД цикла можно записать в виде
. Поэтому КПД цикла можно записать в виде
 . (2.5)
. (2.5)
Поскольку рассматривается цикл Карно, КПД этого цикла можно записать, используя теорему Карно:
 . (2.6)
. (2.6)
Приравняв выражение (2.5) и (2.6), получим
 . (2.7)
. (2.7)
Соотношение (2.7) называется уравнением Клапейрона-Клаузиуса. Его можно использовать для определения теплоты парообразования жидкости. Учитывая, что при температурах, далеких от критической,  , получаем
, получаем
 . (2.8)
. (2.8)
На участках невысоких давлений к пару можно применить законы идеального газа, и тогда удельный объем 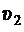 можно определить из уравнения Клапейрона-Менделеева:
можно определить из уравнения Клапейрона-Менделеева:
 . (2.9)
. (2.9)
Подставляя значение 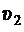 из формулы (2.9) в соотношение (2.8), получим
из формулы (2.9) в соотношение (2.8), получим
 . (2.10)
. (2.10)
Считая величину q постоянной для исследуемого интервала изменения температуры, проинтегрируем уравнение (2.10)
 . (2.11)
. (2.11)
Полученная формула устанавливает связь между молярной теплотой парообразования воды, давлением и температурой водяного пара. Изменяя температуру пара T, необходимо построить график зависимости  , по угловому коэффициенту которого
, по угловому коэффициенту которого  можно определить молярную теплоту парообразования воды.
можно определить молярную теплоту парообразования воды.
Постоянную интегрирования можно найти, если известно давление насыщенного пара P 0 при какой – либо одной температуре T 0. При этой температуре
 (2.12)
(2.12)
Исключая постоянную интегрирования, получим
 (2.13)
(2.13)
Соотношение (2.13) выражает зависимость давления насыщенного пара от температуры.
Не нашли, что искали? Воспользуйтесь поиском: