
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретическая часть. Ознакомление с одним из методов определения молярной массы и плотности газа.
ЛАБОРАТОРНАЯ РАБОТА № 124
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ И ПЛОТНОСТИ ГАЗА МЕТОДОМ ОТКАЧКИ
Цель работы
Ознакомление с одним из методов определения молярной массы и плотности газа.
Теоретическая часть
Состояние некоторой массы газа определяется значениями трёх параметров: давлением P, под которым находится газ, его температурой T и объёмом V. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечёт за собой изменение других. Указанная связь может быть задана аналитически в виде функции
 . (2.1)
. (2.1)
Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния этого тела. Следовательно, (2.1) представляет собой уравнение состояния данной массы газа.
Если разрешить (2.1) относительно какого-либо из параметров, например P, уравнение состояния примет вид:
 . (2.2)
. (2.2)
Это значит, что состояние газа определяется только двумя параметрами (например, давлением и объёмом, давлением и температурой или, наконец, объёмом и температурой), третий параметр однозначно определяется двумя другими. Если уравнение состояния известно в явном виде, то любой параметр можно вычислить, зная два других.
При не очень высоких давлениях, но достаточно высоких температурах газ можно считать идеальным. Под идеальным газом подразумевают такой газ, в котором можно пренебречь взаимодействием между молекулами, а молекулы принять за материальные точки. Состояние такого газа описывается уравнением Менделеева – Клайперона:
 , (2.3)
, (2.3)
где Р – давление газа, V – объём газа, m – масса газа, μ – молярная масса газа, R = 8,31 Дж/(моль·К) – универсальная газовая постоянная, Т – абсолютная температура газа.
Молярной массой называется масса одного моля вещества. В единицах СИ эта величина измеряется в килограммах на моль. Молем какого-либо вещества называется количество этого вещества, содержащее столько же структурных элементов (молекул, атомов, и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода 12C. Молярную массу газа можно определить из уравнения газового состояния.
Из уравнения (2.3) можно получить формулу молярной массы газа:
 . (2.4)
. (2.4)
Если измерение давления Р, объёма V, температуры Т газа, т.е. параметров газа, входящих в формулу (2.4) не вызывает особенных трудностей, то определение массы газа выполнить практически невозможно, так как взвешивание газа возможно только вместе с сосудом, в котором он находится. Поэтому для определения μ необходимо исключить массу сосуда. Это можно сделать, рассмотрев уравнение состояния двух масс m 1 и m 2 одного и того же газа при неизменных температуре Т и объёме V.
Пусть в колбе объёмом V находится газ массой m1 при давлении P 1 и температуре Т. Уравнение состояния (2.3) для этого газа имеет вид:
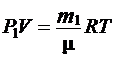 . (2.5)
. (2.5)
Откачаем часть газа из колбы, не изменяя его температуры. После откачки масса газа, что оставалась в колбе, и его давление уменьшились. Обозначим их соответственно m 2 и P 2 и снова запишем уравнение состояния:
 . (2.6)
. (2.6)
Из уравнений (2.5) и (2.6) получим:
 . (2.7)
. (2.7)
Полученная формула (2.7) даёт возможность определить μ, если известны температура, объём, изменение массы газа (но не сама масса), а также изменение давления.
В данной лабораторной работе исследуемым газом является воздух, который представляет собой смесь азота, кислорода, аргона и других газов.
Формула (2.7) пригодна и для определения μ смеси газов. Найденное в этом случае значение μ представляет собой некоторую среднюю или эффективную молярную массу смеси газов. Молярная масса смеси газов может быть рассчитана и теоретически.
Пусть в сосуде объёмом V имеется находящаяся в состоянии теплового равновесия смесь различных газов, не реагирующих химически друг с другом. Для такой смеси уравнение состояния имеет вид:
 , (2.8)
, (2.8)
где μ с – молярная масса смеси газов.
С другой стороны, согласно закону Дальтона давление смеси газов равно сумме парциальных давлений её компонентов
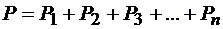 , (2.9)
, (2.9)
где 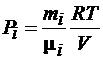 – парциальное давление i = 1,2,3… n – компоненты смеси газов.
– парциальное давление i = 1,2,3… n – компоненты смеси газов.
Из уравнений (2.8) и (2.9) получим:
 , (2.10)
, (2.10)
где 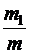 ,
,  ,...
,...  – относительное содержание каждой компоненты смеси газов.
– относительное содержание каждой компоненты смеси газов.
Если известна молярная масса газа, то можно легко определить ещё одну важную характеристику газа – его плотность ρ. Плотность газа – это масса единицы объёма газа:
 . (2.11)
. (2.11)
Определив 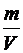 из уравнения Менделеева – Клайперона, получим
из уравнения Менделеева – Клайперона, получим
 . (2.12)
. (2.12)
Плотность смеси газов можно вычислить по формуле (2.12), подразумевая под μ эффективную молярную массу смеси.
Не нашли, что искали? Воспользуйтесь поиском: