
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторная работа № 23
Исследование pv-диаграммы углекислого газа. Опыт Эндрюса
Цель работы: ознакомиться с общими свойствами идеальных и реальных газов; освоить методику экспериментального определения зависимости p-v-t реальных газов.
Задание.
1. Провести опыты по изотермическому сжатию углекислого газа (СО2) при температурах, указанных преподавателем:  ,
,  ,
, 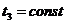 .
.
2. На основании опытных данных построить pv -диаграмму для исследованного газа.
3. Рассчитать коэффициент неидеальности  .
.
4. Составить отчет о выполненной работе, который должен содержать: задание, основы теории (кратко), схему экспериментальной установки, таблицу опытных данных, результаты обработки и pv -диаграмму, выполненную на миллиметровой бумаге.
Основы теории
Идеальным газом называется воображаемый газ, молекулы которого представляют собой материальные точки, не имеющие собственного объема и не взаимодействующие между собой. Зависимость между основными термодинамическими параметрами такого газа определяется уравнением состояния идеального газа – уравнением Клапейрона-Менделеева:
 , (1)
, (1)
где 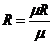
 - газовая постоянная;
- газовая постоянная;

 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Реальные газы состоят из молекул, имеющих конечный собственный объем, между которыми действуют силы межмолекулярного взаимодействия (силы притяжения и отталкивания). Эти газы описываются уравнением (1) только при малых плотностях, когда среднее расстояние между центрами молекул сравнительно велико, и эти силы не проявляются. В более плотных реальных газах со значительно меньшим расстоянием между молекулами необходимо учитывать и эти силы, и собственный объем молекул. Поведение реальных газов качественно отражает уравнение Ван-дер-Ваальса:
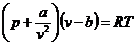 , (2)
, (2)
где  - называют внутренним давлением (для жидкостей оно велико), учитывает силы взаимодействия между молекулами;
- называют внутренним давлением (для жидкостей оно велико), учитывает силы взаимодействия между молекулами;
 - учитывает собственный объем молекул - это наименьший объем, до которого можно сжать газ.
- учитывает собственный объем молекул - это наименьший объем, до которого можно сжать газ.
Для количественных расчетов уравнение (2) часто малопригодно, т.к. при высоких плотностях, а следовательно, при высоких давлениях параметры, рассчитанные по этому уравнению, расходятся с действительными (экспериментальными) значениями.
Уравнение Ван-дер-Ваальса можно представить в приведенных параметрах состояния. Если переменные p, v и T отнести к их значениям в критической точке 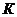 (далее в опыте Эндрюса эта точка будет рассмотрена подробнее), то можно получить приведенные значения объема
(далее в опыте Эндрюса эта точка будет рассмотрена подробнее), то можно получить приведенные значения объема  , давления
, давления  и температуры
и температуры  и записать так называемое приведенное уравнение состояния:
и записать так называемое приведенное уравнение состояния:
 . (3)
. (3)
Состояния веществ, находящихся при одинаковых  ,
,  и
и  , называются соответственными состояниями.
, называются соответственными состояниями.
Уравнения типа (2) и (3) получаются в случае, если ограничиться рассмотрением только парных взаимодействий между молекулами, т.е. в группах по две молекулы. Поэтому эти уравнения применимы в области не очень высоких давлений.
С повышением давления необходимо учитывать образование устойчивых молекулярных образований из трех, четырех и более молекул, распад которых возможен только при подводе энергии извне, т.е. при нагревании. Такой газ можно рассматривать как «смесь» нескольких газов, частицами которых являются одиночные, двойные, тройные и т.д. группы молекул.
Уравнение состояния реальных газов формально можно записать в виде:
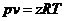 , (4)
, (4)
где z - коэффициент сжимаемости (для идеальных газов z = 1) - можно представить в виде вириального уравнения, учитывающего и взаимодействия более высокого порядка:
 . (5)
. (5)
Правую часть этого уравнения можно рассматривать как разложение в ряд коэффициента z по степеням плотности  . Зависящие от температуры функции
. Зависящие от температуры функции 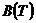 ,
,  ,
,  … выступают здесь как вириальные (от латинского vires - силы) коэффициенты, учитывающие соответственно парные, тройные, четверные и т.д. взаимодействия. Область справедливости вириального разложения ограничивается сходимостью рядов. Ряды расходятся при плотностях, соответствующих жидкому состоянию. Уравнение (5) оказывается справедливым для газов умеренной плотности.
… выступают здесь как вириальные (от латинского vires - силы) коэффициенты, учитывающие соответственно парные, тройные, четверные и т.д. взаимодействия. Область справедливости вириального разложения ограничивается сходимостью рядов. Ряды расходятся при плотностях, соответствующих жидкому состоянию. Уравнение (5) оказывается справедливым для газов умеренной плотности.
Второй вириальный коэффициент может быть определен по значениям потенциальной энергии взаимодействия - силам притяжения и отталкивания - двух молекул 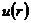 в зависимости от расстояния между ними:
в зависимости от расстояния между ними:
 , (6)
, (6)
где NA - число Авогадро, NA = 6,022×1026  ;
;
КБ - постоянная Больцмана, КБ = 1,38×10-23  ;
;
кстати 
 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Определение последующих вириальных коэффициентов для газов достаточно большой плотности облегчается при наличии экспериментально полученных данных по теплофизическим свойствам этих газов (теплоемкость, вязкость, теплопроводность и т.п.).

Коэффициент неидеальности z может быть найден также по зависимости  из
из  - диаграммы (рис.1).
- диаграммы (рис.1).
|
|
Рассчитанное значение  откладывается на соответствующей оси этой диаграммы и из этой точки проводится прямая, перпендикулярная оси
откладывается на соответствующей оси этой диаграммы и из этой точки проводится прямая, перпендикулярная оси  до пересечения с кривой, соответствующей рассчитанному значению t. Точка пересечения позволяет определить искомую величину коэффициента неидеальности на оси z.
до пересечения с кривой, соответствующей рассчитанному значению t. Точка пересечения позволяет определить искомую величину коэффициента неидеальности на оси z.
Точность расчетов в этом случае окажется такой же, как и по уравнению Ван-дер-Ваальса (2) или приведенному уравнению (3)
Опыт Эндрюса
Свойства реальных газов не только в количественном, но и в качественном отношении отличаются от свойств реальных газов. Теория идеальных газов не может объяснить фазовые превращения газа и жидкости, она не может установить границы области фазовых переходов, параметры критического состояния.
В 1869 г. английский физик Эндрюс впервые на основании проведенных им экспериментов по изотермическому сжатию СО2 построил pv -диаграмму для реального газа и показал на ней характерные граничные линии и области состояний.
|

|
|
|
|
|
|
|
|
|
|
|
 ) сжатия можно по pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 давление газа достигает величины рн – давления насыщения при данной температуре t и газ начинает конденсироваться при
) сжатия можно по pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 давление газа достигает величины рн – давления насыщения при данной температуре t и газ начинает конденсироваться при  и
и  , процесс 2-3.
, процесс 2-3.
В точке 3 процесс конденсации завершается.
Кривая 3-4 соответствует процессу сжатия жидкой фазы при  . Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
. Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
Исследуя зависимость v от р на разных изотермах t, t’, t” и т.д., Эндрюс установил, что чем выше температура, тем меньше разница между удельными объемами сухого насыщенного пара  и насыщенной жидкости
и насыщенной жидкости 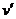 . С повышением температуры
. С повышением температуры 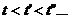 точки 2,
точки 2, 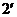 ,
,  …, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3,
…, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3,  ,
,  …, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
…, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
х =  ,
,
где  - масса сухого насыщенного пара,
- масса сухого насыщенного пара,
 - масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
- масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
Разность удельных объемов 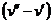 уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.
уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.  . Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами.
. Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами.
Таким образом, для реального газа в pv -диаграмме можно выделить три характерные области:
· область жидкого состояния – расположена левее кривой х = 0 (БК),  ;
;
· область двухфазных состояний – влажного насыщенного пара, расположенную между линиями х = 0 и х = 1 (между БК и АК),  ;
;
· область перегретого пара, расположенную правее кривой х = 1 (АК),  .
.
Нетрудно видеть, что при  путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Этим объясняется то, что газы, у которых
путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Этим объясняется то, что газы, у которых  , без понижения температуры не переходят в жидкое состояние.
, без понижения температуры не переходят в жидкое состояние.
В таблице 1 приведены критические параметры некоторых реальных газов.
Таблица 1
| Параметры | Н2 | N2 | CO2 | O2 | H2O | Hg |
| tкр ., °С | -239,9 | -147,0 | 31,05 | 118,4 | 374,15 | |
| ркр ., МПа | 1,293 | 3,39 | 7,837 | 5,07 | 22,13 | 147,0 |
| vкр ., м3/кг | 0,0323 | 0,00322 | 0,002137 | 0,00233 | 0,00326 | - |
Вещество в критическом состоянии имеет ряд особенностей. Критическая изотерма tкр . в критической точке К имеет горизонтальную касательную и перегиб, т.е.
 и
и  . (7)
. (7)
Вблизи этой точки наблюдается скачек теплоемкости  . В точке К теплота парообразования
. В точке К теплота парообразования  , становятся равными нулю силы поверхностного натяжения
, становятся равными нулю силы поверхностного натяжения 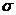 , которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
, которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
Особые свойства веществ в критической и околокритической областях состояния в настоящее время уже находят применение в пищевой, фармацевтической, парфюмерной, химической, нефте- и углеперерабатывающей отраслях промышленности, в решении экологических проблем. В частности, «предложено использование суб- и сверхкритических флюидов в роли экстрагентов и растворителей в процессах выделения, разделения, очистки и фракционирования» /3/. При этом решаются проблемы создания перспективных энергосберегающих и малоотходных технологий.
Проведение опытов
 |
|
Изменение объема газа при сжатии и происходящая при этом конденсация четко фиксируется по положению границы ртути в капилляре с помощью шкалы на мерной линейке 7.
Температура в ячейке измеряется ртутным термометром 8, избыточное давление сжимаемого газа – образцовым манометром.
Работа выполняется в следующей последовательности:
Перед проведением опытов измерить и записать атмосферное давление В и цену деления шкалы манометра.
1. Включить термостат с мешалкой. Установить на термостате заданную температуру опыта t1 и дождаться ее установления в измерительной ячейке. Значение этой температуры занести в таблицу 2.
2. Вращая маховик масляного пресса, сжать газ настолько, чтобы в поле зрения капилляра появился мениск ртути. Занести в таблицу 2 показания манометра ризб . (в делениях) и по шкале мерной линейки высоту газа в капилляре l, мм, пропорциональную сжимаемому объему СО2.
3. Повышать давление (по 2 деления шкалы манометра) до появления мениска конденсата над ртутным столбиком (точка 2 на рис. 2). Данные занести в таблицу измерений 2, где отметить точку 2.
4. Сжать газ до давления, соответствующего 50 делениям манометра и перевести вещество в жидкое состояние. Занести в таблицу высоту жидкости l отметить в таблице эту точку (точка 4 на рис. 2).
Таблица 2
| №№ опытных точек | |||||||||||||||||
| t1 =, °С | ризб. | делений | |||||||||||||||
| кгс/см2 | |||||||||||||||||
| рабс. | МПа | ||||||||||||||||
| l | мм | ||||||||||||||||
| v | м3/кг | ||||||||||||||||
| В =, мм рт. ст. | Шкала манометра 1 дел =, кгс/см2 |
5. Вращением маховика пресса понижать давление по 2 деления за опыт, записывая высоту жидкости в капилляре. После появления в капилляре газа над жидкостью опыты прекратить.
6. По указанию преподавателя повторить действия п.п. 1-4 при температуре t2.
7. Показать результаты измерений преподавателю.
Положение точки 3 на pv -диаграмме (рис. 2) определяется графическим построением. Она находится на пересечении горизонтальной прямой через точку 2 и вертикальной прямой, проходящей через точку 4.
Не нашли, что искали? Воспользуйтесь поиском: