
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПРАКТИЧЕСКАЯ РАБОТА
5.1 Определение термодинамических функций реакции
По таблице вариантов (приложение 2) определить задание по выполнению практической работы. В таблице даны варианты задания (содержащего уравнение химической реакции и температуры), по которым необходимо выполнять некоторые расчеты.
5.2. Вычислить следующие параметры:
а) тепловой эффект реакции в стандартных условиях;
б) изменение энтропии реакции в стандартных условиях;
в) изменение энергии Гиббса при стандартных условиях;
г) изменение энергии Гиббса при стандартном давлении и заданной температуре;
д) сделать вывод по результатам расчета о термохимическом характере реакции и возможностиее протекания в прямом направлении.
Пример выполнения практической работы
| Термодинами-ческие характеристики | Реагирующие вещества | Термохимическое уравнение | |||
| Сl2(г) | Н2О(г) | НCl(г) | О2(г) | ||
| DНf , кДж×моль–1 | -241,83 | -91,80 | 2Сl2(г) +2Н2О(г) = = 4НCl(г) +О2(г), DН0х.р = 116,46 кДж Реакция эндотермическая, DН0х.р> 0 | ||
| S0, Дж×моль×K–1 | 222,95 | 188,72 | 186,8 | 205,04 | |
| DН0х.р., кДж | 116,46 | ||||
| DS0 х.р., кДж×К–1 | 0,1289 | ||||
| Т, К | 37+273= 310 | ||||
| DG0 , кДж | 78,05 | ||||
| DGт, кДж | 76,5 |
1. Вычисление теплового эффекта реакции в стандартных условиях.
D H х.р.= SDH0f прод× - SDHf0 исх× = 4(-91,80) - 2(-241,83)= 116,46 кДж
2. Вычисление изменения энтропии реакции в стандартных условиях
D S х.р. = SS°прод. - SS°исх. = (4*186,8 + 205,04)- (2*222,95 + 2*188,72)*10-3= 128,9 Дж = 128,9*10-3= 0,1289 кДж
3. Вычисление изменения энергии Гиббса при стандартных условиях
DGо = DH - TDS = 116,46 – 298* 0,1289 = 78,05 кДж
4. Вычисление изменения энергии Гиббса при стандартном давлении и заданной температуре
DGт = DH - TDS = 116,46 – 310* 0,1289= 76,5 кДж
5.Данная реакция не протекает при 298К и 310К, тк свободная энергия Гиббса имеет положительное значение, DG> 0
5.3. Все справочные данные и результаты вычислений необходимо представить в виде табл 5.1. Энтальпии образования соединений DНf и их абсолютные энтропии приведены в приложении 2.
Таблица 5.1
Результаты вычислений термодинамических функций реакции
| Термодинами-ческие характеристики | Реагирующие вещества | Термохимическое уравнение | |||
| DНf , кДж×моль–1 | |||||
| S0, Дж×моль×K–1 | |||||
| DН0х.р., кДж | |||||
| DS0 х.р., кДж×К–1 | |||||
| Т, К | |||||
| DG0 , кДж | |||||
| DGт, кДж |
5.4. Расчет проводится в единицах абсолютной шкалы температур. Для перехода 0С в единицу абсолютной шкалы температур использовать соотношение Т= to C + 273.
При расчетах энтропийные единицы Дж×К–1 перевести в кДж×К–1, разделив полученный результат на 1000.
| Приложение 1 Варианты задания для расчета термодинамических функций | |||||
| № вар. | Реакция | t,оС | № вар. | реакция | t,оС |
| 2Н2S(г) +SО2(г) = = 2Н2О(ж) +3S(т) | СаСО3(т) = = СаО(т) + СО2(г) | ||||
| 2Сl2(г) +2Н2О(г) = = 4НCl(г) +О2(г) | NН3(г) + НСl(г) = = NН4Cl(т) | ||||
| 2КСlO3(т) = = 2КСl(т) + 3О2(г) | Р2О5(т) + 3Н2О(ж) = = 2Н3РО4(ж) | ||||
| 2SО2(г) +О2(г) = = 2SО3(г) | 4НСl(г) + О2(г) = = 2Н2О(г) + 2Сl2(г) | ||||
| SO2(г) + Cl2(г) = = SO2Cl2(ж) | В2О3(т) + 3Мg(т) = = МgО (т) + В(т) | ||||
| S(т) + 2Н2О(ж) = = SО2(г) + 2Н2(г) | 3Аs2О3(т) + О2(г) = = 3Аs2О5(т) | ||||
| Са(ОН)2(т) = = СаО(т) + Н2О(г) | СН4(г) + СО2(г) = =2СО(г) + 2Н2О(г) | ||||
| 2NO2(г)=2NО(г)+ О2(г) | Fe2O3(т) + 3Н2(г) = = 2Fe(т) + 3Н2О(г) | ||||
| 4NO(г) + 6Н2О(г) = = 4NН3(г) +5О2(г) | СО(г) + Н2О(г) = = СО2(г) + Н2(г) | ||||
| СО(г) + SО2(г) = = S(т) + СО2(г) | СО(г) +Fe3O4(т) = = CO2(г) + FeO(т) | ||||
| СН4(г) + О2(г) = = СО2(г) + Н2О(г) | РСl(г) = = РСl3(г) + Сl2(г) | ||||
| 2Н2(г) + СО (г) = = СН3ОН (г) | ТiО2(т) + С(т) = Тi(т) + СО(г) | ||||
| СS2(г) + О2(г) = = 2SО2(г) + СО2(г) | FeO(т)+H2(г)= =Fe(т)+H2O(ж) | ||||
| Ca(OH)2(ж)+CO2(г)= =CaCO3(т) | S(т)+H2O(ж)= =H2S(г)+SO2(г) | ||||
| H2O(ж)= =H2(г)+O2(г) | TiO2(т)+CO(г)= =Ti(т)+CO2(г) |
Приложение 2
Термодинамические характеристики некоторых соединений
| Вещество | Состояние | ΔHf,° кДж×моль-1 | S°, Дж×К-1 ×моль-1 | ΔGf°, кДж×моль-1 | Ср, Дж×К-1×моль-1 |
| As2O3 | т | -1331,6 | 245,0 | -576,16 | 95,65 |
| As2O5 | т | -924,9 | 105,4 | -478,69 | 117,5 |
| B | т | 5,86 | 11,96 | ||
| B2O3 | т | -1254,0 | 80,8 | -1119,99 | 62,97 |
| BaCO3 | т | -1202,3 | 112,1 | -1138,8 | 85,35 |
| BeCO3 | т | -944,75 | |||
| C | графит | 5,74 | 8,53 | ||
| Ca(OH)2 | т | -986,50 | 76,1 | -898,5 | 87,5 |
| CaCO3 | т | -1207,0 | 92,9 | -1129,0 | 81,35 |
| CaO | т | -635,5 | 39,7 | -604,17 | 42,8 |
| CH3OH | г | -201,17 | 239,47 | -161,9 | 43,9 |
| CH4 | г | -74,86 | 186,19 | -50,8 | 35,79 |
| Cl2 | г | 222,95 | 33,84 | ||
| CO | г | -110,52 | 198,04 | -137,3 | 29,15 |
| CO2 | г | -393,51 | 213,78 | -394,4 | 37,13 |
| CS2 | г | +115,28 | 237,82 | 66,55 | 45,65 |
| Fe | т | 27,2 | 25,23 | ||
| Fe2O3 | т | -822,10 | 89,96 | -740,98 | 103,7 |
| Fe3O4 | т | -1117,1 | 146,2 | -1014,62 | 143,4 |
| FeO | т | -264,8 | 60,75 | -244,6 | 48,2 |
| H2 | г | 130,52 | 28,83 | ||
| H2O | ж | -285,84 | 70,08 | -236,81 | 75,31 |
| H2O | г | -241,83 | 188,72 | -228,61 | 33,56 |
| H2S | г | -20,15 | 205,64 | -99,01 | 33,93 |
| H3PO4 | ж | -1288,3 | -158,1 | -1134,00 | 100,1 |
| HCl | г | -91,80 | 186,8 | -95,27 | 29,16 |
| KCl | т | -435,9 | 82,56 | -408,3 | 51,49 |
| KClO3 | т | -391,2 | 142,97 | -289,9 | 100,25 |
| Mg | т | 35,55 | 24,8 | ||
| MgO | т | -601,8 | 26,9 | -569,0 | 37,41 |
| N2 | г | 199,9 | 29,10 | ||
| NH3 | г | -46,19 | 192,63 | -16,0 | 35,65 |
| NH4Cl | т | -314,2 | 95,8 | -203,0 | 84,1 |
| NO | г | +90,37 | 210,60 | 86,71 | 29,83 |
| NO2 | г | -33,0 | 240,20 | 51,84 | 37,11 |
| O2 | г | 205,04 | 29,36 | ||
| OH– | ж | -229,94 | -10,54 | -157,3 | - |
| P2O5 | т | -2984,0 | 228,9 | -2675,2 | 204,8 |
| PCl3 | г | -287,02 | 311,66 | -272,4 | 72,05 |
| PCl5 | г | -366,0 | 364,50 | -305,10 | 111,9 |
| S | т | 31,9 | 22,6 | ||
| SO2 | г | -296,9 | 248,1 | -300,4 | 39,87 |
| SO2Cl2 | ж | -391,2 | 216,3 | -321,49 | 131,8 |
| SO3 | г | -396,1 | 256,4 | -370,4 | 50,63 |
| SrCO3 | т | -1144,74 | 107,57 | -1032,42 | 107,79 |
| Ti | т | 30,7 | 25,0 | ||
| TiO2 | т | -943,9 | 50,33 | -888,6 | 62,34 |
6. Контрольные вопросы к практикуму.
6.1. Назовите основные термодинамические параметры и функции.
6.2. Что в химическом процессе характеризует термодинамическая функция энтальпия?
6.3. Дайте формулировку закона Гесса и его следствия.
6.4. Что такое энтальпия образования соединения? Напишите термохимическое уравнение реакции образования диоксида углерода из углерода и кислорода.
6.5. Что определяет термодинамическая функция энтропия? Рассчитайте энтропии реакции образования диоксида углерода из углерода и кислорода, пользуясь справочными данными из термодинамических таблиц. (приложение 3).
6.6.Что характеризует термодинамическая функция энергия Гиббса? Связь между энергией Гиббса, энтальпией и энтропией. Термодинамическое условие протекания химического процесса.
6.7. Какие из карбонатов: BeCO3, CaCO3, SrCO3 или BaCO3 можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция протекает наиболее энергично? Вывод сделайте, вычислив ΔG0 реакций. При вычислениях используйте данные приложения 4.
6.8. Как будет изменяться энтропия в ряду:
NaF—NaCl—NaBr—NaI
6.9. Предскажите, каким будет изменение энтропии системы в перечисленных ниже реакциях – положительным или отрицательным:
а) H2O(ж)→ H2O(г) при 298 К,
б) CaCO3(т) → CaO(т) + CO2(г),
в) N2(г) + 3H2(г) → 2NH3(г),
г) N2(г) + O2(г) → 2NO(г),
д)Ag+(ж) +Cl-(ж) → AgCl(т).
6.10. Тепловой эффект какой реакции равен энтальпии образования метана? Вычислите энтальпию образования метана, исходя из следующих термохимических уравнений:
1) Н2(г) + 1/2О2(г) = Н2О(ж), ΔН1 = -285,84 кДж,
2) С(т) + О2(г) = СО2(г), ΔН2 = -393,51 кДж,
3)СН4(г) + 2О2(г) = 2Н2О(ж), ΔН3 = - 890,31 кДж.
6.11. При сгорании 11,5 г жидкого этанола выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. вычислить энтальпию образования С2Н5ОН(ж).
6.12. Зная тепловой эффект и абсолютные энтропии соответствующих веществ (приложение 3) определите ΔG0 следующей реакции:
Н2(г) + СО2(г) = СО(г) + Н2О(ж), ΔН = - 2,85 кДж
Чем можно объяснить, что при стандартных условиях протекание данной реакции невозможно?
6.13. Прямая или обратная реакция будет протекать при стандартных условиях в системе

 2NO(г) + О2(г) 2NO2(г)
2NO(г) + О2(г) 2NO2(г)
Ответ мотивируйте, вычислив ΔG0 реакции.
6.14. При какой температуре наступит равновесие в системе

 СН4(г) + СО2(г) 2СО(г) + 2Н2(г)
СН4(г) + СО2(г) 2СО(г) + 2Н2(г)
6.15. Вычислите все термодинамические функции реакции

 TiO2(т) + C(т) Ti(т) + CO(г)
TiO2(т) + C(т) Ti(т) + CO(г)
Возможна ли данная реакция при Т = 1000К и Т = 3000К?
7.Теоретическая часть
Химическая термодинамика изучает взаимные превращения различных видов энергии в химической системе, законы этих превращений, направление самопроизвольного протекания химической реакции. Совокупность физических и химических свойств системы характеризует ее состояние. Состояние систем описывается термодинамическими параметрами: температурой Т, давлением Р, объемом V и концентрацией С.
Изменение любого из этих параметров в системе является термодинамическим процессом. Термодинамический процесс фиксируют термодинамические функции: внутренняя энергия U, энтальпия Н, энтропия S и энергия Гиббса G. Все термодинамические функции являются функциями состояния, то есть их изменение определяется только начальным и конечным состоянием системы и не зависит от пути, по которому протекает процесс.
Внутренняя энергия и энтальпия характеризуют тепловой эффект химической реакции - количество теплоты, выделяющейся или поглощающейся при протекании реакции.
Внутренняя энергия характеризует тепловой эффект при постоянном объеме (изохорный процесс), энтальпия - при постоянном давлении (изобарный процесс). Абсолютное значение внутренней энергии и энтальпии неизвестно. Однако для всех термодинамических расчетов достаточно знать только их изменение DU и DН. Большинство химических процессов протекает при постоянном давлении, поэтому тепловой эффект для них определяет энтальпия DН.
В химических реакциях тепловой эффект может быть отрицательным DН < 0 (теплота выделяется +Qp) или положительным DН > 0 (теплота поглощается -Qp). Если DН < 0, то процесс называется экзотермическим, если DН > 0, то - эндотермическим. Уравнение реакции с указанием агрегатных состояний реагирующих веществ и численным значением теплового эффекта называется термохимическим. Например:
FeO(т) + CO(г) = Fe(т) + CO2 (г); DH = - 13,18 кДж.
Тепловой эффект можно рассчитать или определить экспериментальным путем. Термохимические расчеты проводят на основании закона Гесса: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов реакции, но не зависит от пути протекания реакции. Часто тепловой эффект реакции рассчитывают на основании следствия закона Гесса: тепловой эффект реакции DНх.р равен сумме энтальпий образования DН0f продуктов реакции за вычетом суммы энтальпий образования исходных веществ ΔН0fисх с учетом стехиометрических коэффициентов в уравнении реакции.
D H х.р.= SDH0f прод× - SDHf0 исх× (7.1)
Энтальпией образования данного соединения DH0f называется тепловой эффект реакции образования 1 моля этого соединения из простых веществ, взятых в их устойчивом состоянии при стандартных условиях. Стандартными условиями называется состояние системы при следующих значениях термодинамических параметров: Т = 298 К, Р = 1,013 × 105 Па, С = 1 кмоль×м–З. Тепловой эффект при стандартных условиях обозначают через DH°. Энтальпии образования простых веществ приняты равными нулю. Химические уравнения с указанием агрегатных состояний реагирующих веществ теплового эффекта называется термохимическим.
Пример7.1. Вычислите тепловой эффект реакции горения аммиака
4NH3(г) + 3O2(г) = 2N2 (г) + 6H2O (ж) ; D Hх.р. =?
Решение. Из приложения 2 находим значение энтальпий образования аммиака в газообразном состоянии и воды в жидком состоянии.
D Hf NH3(г) = - 46,19 кДж×моль–1; D H°f H2O (ж) = - 285,84 кДж×моль–1
D H°f O2(г) = 0, D H°f N2(г) = 0 по определению.
На основании следствия закона Гесса
D Hх.р. = 6 × D H°f H2O (ж) - 4D H°f NH3(г) =
= 6 (-285,84) - 4(- 46,19) = - 1530,28 кДж.
Пример 7.2. Тепловой эффект какой реакции равен энтальпии образования NO? Вычислите энтальпию образования NO, исходя из следующих термохимических уравнений:
1) 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж); DH1= - 1168,8 кДж;
2) 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); DH2= - 1530,28 кДж.
Решение. Этальпия образования NO - это тепловой эффект реакции
3) 1/2 N2(г) + 1/2O2(г) = NO(г); DHf NO =?
В соответствии с законом Гесса термохимические уравнения обладают свойством аддитивности, то есть с ними можно проводить все алгебраические операции. Вычтем из термохимического уравнения (1) уравнение (2). Получим:
4NH3(г) + 5O2(г) - 4NH3(г) - 3O2(г) =
= 4NO(г) + 6H2O(ж) - 2N2(г) - 6H2O(ж)
DH1 - DH2= 361,48 кДж.
После перенесения N2 в левую часть уравнения и деления уравнения на 4 получим:
1/2 N2(г) + 1/2O2(г) = NO (г); DHf = 90,37 кДж
Пример 7.3. При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите энтальпию образования С2Н2(г).
Решение. Напишите термохимическое уравнение реакции горения ацетилена:
С2Н2(г) +5/2О2(г) = Н2О(г) + 2СО2(г), ΔНх.р. = х кДж.
Найдем количество вещества ацетилена (n(C2H2)) в реакции горения по условию задачи:
V(C2H2) 1
n(C2H2) = ———— = —— = 0,0446 моль.
Vm 22,4
Рассчитаем количество теплоты, выделевшейся при сгорании 1 моль ацетилена Qm:
Q1
Qm = ————,
n(C2H2)
где Q1 – количество теплоты, выделившейся при сгорании 0,0446 моль ацетилена.
56,053
Qm = ———— = 1256,79 кДж.
0,0446
Энтальпия реакции ΔНх.р. = -Qm = - 1256,79 кДж.
По закону Гесса ΔНх.р. = 2ΔНf0(СО2) + ΔНf0(Н2О) – ΔНf0(С2Н2),
оттуда ΔНf0(С2Н2) = 2ΔНf0(СО2) + ΔНf0(Н2О) – ΔНх.р..
Из приложения 2 ΔНf0(СО2) = -393,51 кДж×моль–1 ,
ΔНf0(Н2О) = - 241,83 кДж×моль–1 ;
ΔНf0(С2Н2) = -(2×393,51 + 241,81) + 1256,79 = +227,94 кДж.
Кроме энтальпий химических превращений, существуют энтальпии фазовых превращений: энтальпия испарения DHисп., энтальпия плавления DHпл. и т.д.
Термодинамическая функция - энтропия S характеризует меру беспорядка системы и является критерием самопроизвольного процесса. В отличие от энтальпии абсолютное значение энтропии не равно нулю и зависит от температуры. При абсолютном нуле абсолютная энтропия равна нулю, с увеличением температуры энтропия возрастает. Необходимо ориентироваться в возможном изменении энтропии веществ и реакций. Все факторы, способствующие увеличению беспорядка системы, приводят к возрастанию энтропии. Например:
1. Энтропия возрастает при переходе вещества из твердого состояния через жидкое к газообразному;
2. Энтропия возрастает в процессе растворения жидкого или твердого вещества и уменьшается в процессе растворения газообразного вещества в воде;
3. Энтропия возрастает при повышении массы частиц вещества при прочих равных условиях;
4. Энтропия тем больше, чем сложнее химический состав вещества;
5. С увеличением объема образующихся в реакции веществ энтропия возрастает.
Энтропия химической реакции D Sх.р. равна сумме абсолютных энтропий продуктов реакций за вычетом суммы абсолютных энтропий исходных веществ с учетом стехиометрических коэффициентов.
D S х.р. = SS°прод. - SS°исх. , (7.2),
где S° - абсолютные энтропии реагирующих веществ в стандартных условиях, Дж×моль-1×К-1.
В отличие от энтальпий образования простых веществ абсолютные энтропии простых веществ не равны нулю. Значения стандартных энтропий веществ приводятся в термодинамических таблицах.
Пример 7.4. Определите изменение энтропии DS х.р. в следующих реакциях:
1) N2(г)+ 3H2(г) = 2NH3(г),
2) CO2(г) + C(т) = 2CO(г),
3) CaO(т) + SiO2(т) = CaSiO3(т).
Сделайте вывод о характере изменения энтропии и объема
системы с газообразными компонентами, а также связи между ними.
Решение. Из термодинамических таблиц (приложение 3) найдем стандартные абсолютные энтропии реагирующих веществ и по формуле (7.2) - изменение энтропии DS х.р указанных реакций.
Для реакции (1) S°N2(г) = 199,9 Дж×моль-1×К-1
S°H2(г) = 130,52 Дж×моль–1×К–1; S°NH3(г) = 192,63 Дж×моль-1×К-1
DSх.р. = 2 SNH3(г) -(S°N2(г) + 3S°H2(г))=
= 2×192,63 - (199,9 + 130,52) = - 103,1 Дж×моль-1×К-1;
DSх.р. < 0, объем системы (число молей) уменьшился в 2 раза.
Для реакции (2) S°CO2(г) = 213,78 Дж×моль-1×К-1;
S°C(т) = 5,74 Дж×моль–1×К–1; S°CO(г) = 198,04 Дж×моль-1×К-1;
DSх.р. = 2 SCO(г) - (S°CO2(г) + S°C(т)) =
= 2×198,04 - (213,78 + 5,74) = 88,28 Дж×моль-1×К-1;
DSх.р. > 0, объем системы (число молей) увеличился в 2 раза.
Для реакции (3) S°CaO(т) = 39,7 Дж×моль-1×К-1;
S°SiO2(т) = 41,86 Дж×моль-1×К-1; SCaSiO3(т) = 87,06 Дж×моль-1×К-1
DSх.р. = S°CaSiO3(т) - (S°CaO(т) + S°SiO2(т))=
= 82,06 - (39,7 + 39,7 + 41,86) = 0,49 Дж×моль-1×К-1.
Энтропия увеличилась незначительно, объем практически не изменился.
Для химических реакций с участием газообразных веществ с увеличении ем объема энтропия возрастает, а с уменьшением объема - уменьшается.
Химические процессы имеют тенденцию к уменьшению энтальпии системы, ΔН →min – энтальпийный фактор протекания процесса. В то же время, химические процессы имеют тенденцию к возрастанию энтртопии, ΔS→max – энтропийный фактор протекания процесса. Эти факторы имеют противоположное действие. Поэтому только по энтальпии и только по энтропии невозможно определить направление протекания процесса. Для этого вводится термодинамическая функция - энергия Гиббса.
Термодинамическая функция энергия Гиббса или изобарно -изотермический потенциал DG характеризует направление протекания процесса. Между энтальпией DН, энтропией DS и энергией Гиббса DG существует следующая взаимосвязь:
DG = DH - TDS, (7.4)
где Т - абсолютная температура. Соотношение (7.4) называют основным уравнением химической термодинамики.
Энергия Гиббса химической реакции равна сумме энергий Гиббса образования DG°f продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов
DGx.p. = SDG°f.прод. - SDGof.исх., (7.5)
где DGof - энергия Гиббса реагирующих веществ в стандартном состоянии.
Энергия Гиббса образования простых веществ равна нулю. Значения стандартных энергий Гиббса образования веществ приводятся в термодинамических таблицах.
Термодинамическим условием протекания процесса является отрицательное значение энергии Гиббса, ΔG<0.
Пример 7.5. На основании стандартных энтальпий образования и абсолютных энтропий веществ вычислите DG реакции
Fe2O3(T) + 3C(T) = 2Fe(T) + 3CO(T)
при 500 и 1000К.
Сделайте вывод о характере и возможности протекания данной реакции.
Решение. По термодинамическим таблицам находим стандартные энтальпии образования DHof и абсолютные стандартные энтропии S o (приложение 3) реагирующих веществ:
DНof (Fe2O3(T)) = - 822,1 кДж×моль–1; So (Fe2O3(T)) = - 89,96 Дж×моль-1×К-1;
DНof (C(T))= 0; So (C(T)) = 5,96 Дж×моль-1×К-1;
DНof (Fe(T)) = 0; So (Fe(T)) = 27,2 Дж×моль-1×К-1;
DНof (CO(T))= - 110,52 кДж×моль–1; So (CO(г)) = 197,91 Дж×моль-1×К-1.
По формулам (7.1) и (7.2) находим тепловой эффект реакции DНx.p. и изменение энтропии DS x.p.
DHx.p. = 2 DНof Fe(т) + 3DНof CO(г) - 3DНof C(т) - DНof Fe2O3(т) =
= 2× 0 + 3(-110,52) -3× 0 - (-822,1) = + 490,54 кДж.
DН > 0, реакция эндотермическая. Повышение температуры способствует протеканию прямой реакции.
DSx.p. = 2 So Fe(т) + 3So CO(г) - 3SoC(т) - So Fe2O3(т) =
= 2× 27,2 + 3× 197,91-3× 5,69 - 89,96 = 541,1 Дж×К–1: 1000 =
= 0,5411 кДж×К-1.
Энергию Гиббса при соответствующих температурах находим из основного уравнения химической термодинамики
DG = DH – TΔS.
При 500К DG500 = 490,54 - 500×0,5411 = 219,99кДж DG > 0, следовательно, реакция оксида железа (III) с углеродом при 500 К невозможна.
При 1000 К DG1000 = 490,54 - 1000 × 0,5411 = - 50,56 кДж DG1000 < 0, следовательно, реакция оксида железа (III) с углеродом при 1000 К возможна.
Кроме направления протекания самопроизвольных процессов, с помощью свободной энергии Гиббса можно рассчитать максимальную работу Wmax., которую может совершать система за счет расхода внутренней энергии DU, и теоретически возможный коэффициент полезного действия h. В изобарно-изотермических процессах (р,Т= const) максимальная работа Wmax, которая может быть осуществлена системой сверх работы расширения, равна убыли энергии Гиббса DG, если процесс обратимый, и меньше убыли энергии Гиббса, если процесс необратимый.
-Wmax £ - DG; р,Т = const.
Коэффициент полезного действия h при произвольном изобарно-изотермическом процессе подчиняется неравенству
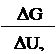 h £,
h £,
где DG и DU -изменение энергии Гиббса и внутренней энергии соответственно.
Это неравенство является одним из математических выражений второго закона термодинамики.
Энергия Гиббса системы в целом может быть рассчитана как сумма энергий Гиббса компонентов системы. Для таких расчетов используют химический потенциал вещества. Химическим потенциалом вещества Х в данной системе называется величина, которая определяется энергией Гиббса, приходящейся на моль этого вещества при заданных условиях:
m(х) =  ,
,
где m(х) - химический потенциал вещества Х, Дж×моль-1;
G(х) - энергия Гиббса вещества Х в системе, Дж;
n(х) - количество вещества X в системе, моль.
Если система состоит из нескольких веществ Х1,Х2...Хi в количествах n(x1), n(x2)... (nxi), то энергия Гиббса системы определяется суммой:
G = n(x1) m (x1) + n(x2) m(x2)... + n(xi) m(xi),
где m (x1), m(x2)... m(xi) - химические потенциалы веществ х1,х2...хi.
Не нашли, что искали? Воспользуйтесь поиском: