
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема: Реальные газы, жидкости и твердые вещества
Х

Величина, стоящая перед синусом, меняется со временем относительно медленно, так как разность частот ω2 – ω1 мала. Эту величину условно называют амплитудой биений, а разность складываемых частот - частотой биений (циклической).
При сложении взаимно перпендикулярных колебаний необходимо найти уравнение траектории тела, то есть из уравнений колебаний типа x = x(t), y = y(t) исключить t и получить зависимость типа y(x).
Если, например, сложим два колебания с одинаковыми частотами
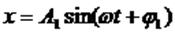
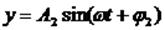
то, исключив время, получим:

В общем случае это - уравнение эллипса, при A1=A2 - окружность, Вид траектории при сложении взаимно перпендикулярных колебаний зависит от соотношения амплитуд, частот и начальных фаз складываемых колебаний. Получающиеся кривые носят название фигур Лиссажу.
Лекция 7
Тема: Упругие волны
Вопросы: 1) Кинематика волновых процессов.
2) Стоячие волны
3) Акустические волны.
1. Если в каком-либо месте упругой (твердой, жидкой или газообразной) среды возбудить колебания ее частиц, то вследствие взаимодействия между частицами это колебание начнет распространяться в среде с некоторой скоростью v. Процесс распространения колебаний называется волной. Частицы среды, в которой распространяется волна, не переносятся волной, они лишь совершают колебания около своих положений равновесия.
В зависимости от направления колебания частиц по отношению к направлению, в котором распространяется волна, различают продольные и поперечные волны. В продольной волне частицы среды колеблются вдоль направления распространения волны. В поперечной волне частицы среды колеблются в направлениях, перпендикулярных к направлению распространения волны. Механические поперечные волны могут возникнуть лишь в среде, обладающей сопротивлением сдвигу. Поэтому в жидкой и газообразной средах возможно возникновение только продольных волн. В твердой среде возможно возникновение как продольных, так и поперечных волн. В продольных волнах вследствие совпадения направлений колебаний частиц и волны появляются сгущения и разрежения. На рисунке ниже показано движение частиц при распространении в среде поперечной волны.

Номерами 1,2,3 и т.д. обозначены частицы, отстоящие друг от друга на расстоянии, проходимом волной за четверть периода колебаний, совершаемых частицами. В начальный момент времени (t = 0) все точки расположены на прямой и ни одна из них не выходит из положения равновесия. Приведем точку 1 в гармоническое колебание с периодом Т, направленное перпендикулярно линии 1-5 (эта линия - ось у в нашем случае). Так как частицы среды связаны между собой силами упругости, они тоже приходят в колебания, но с некоторым запаздыванием. Через четверть периода точка 1 отклонится от линии равновесия на максимальное смещение х = А. Колебание начали все точки, лежащие слева от точки 2. По истечении четверти периода начнет подниматься вверх и точка 2. В момент времени, равный ½ Т первая точка вернется в положение равновесия х = 0, вторая точка достигнет максимального отклонения, и колебания дойдут до точки 3. При t=3/4Т точка 1 достигнет максимального отрицательного смещения х = - А, точка 2 вернется в положение равновесия и колебания достигнут точки 4. Наконец, за время, равное периоду t = Т, точка 1 вернется в положение равновесия, совершив полностью одно колебание. Колебания распространились до точки 5, все колеблющиеся точки образуют волну. При дальнейших колебаниях точек волновой процесс распространится вправо от точки 5. В рассмотренном случае образования поперечной волны каждая частица движется только вверх и вниз. У наблюдателя же создается впечатление, что «волна бежит», хотя в действительности происходит только передача движения от одной точки среды к другой.
В момент времени равный периоду (t = Т), точки 1 и 5, находящиеся в положении равновесия, имеют одинаковое смещение и одинаковое направление движения (вверх). Поэтому говорят, что точки I и 5 имеют одинаковые фазы. В отличие от этого точки 1 и 3, хотя смещения у них одинаковы, движутся в противоположные стороны, поэтому говорят, что точки 1 и 3 находятся в противоположных фазах. Расстояния между точками 1 и 5 определяет длину волны λ. Длиной волныλ называется, расстояние между ближайшими точками волны, колеблющимися в одинаковых фазах. Это расстояние, пройденное волной за период
λ = vТ
Так как период связан с частотой ν соотношением Т= 1/ν, то v= λ ν. Скорость волны определяется скоростью распространения колебаний в среде.
Скорость распространения волн тем меньше, чем инертнее среда, т.е. чем больше ее плотность. С другой стороны, она имеет большее значение в более упругой среде, чем в менее упругой. Скорость продольных волн определяется по формуле:  , а поперечной:
, а поперечной: 
где ρ- плотность среды, E - модуль Юнга, G - модуль сдвига. Так как для большинства твердых тел E>G то скорость продольных волн больше скорости поперечных.
Составим уравнение, которое позволит находить смещение всякой точки волны в любой момент времени. Пусть в некоторой точке упругой среды находится источник колебаний, которые можно задать уравнением
x = Asinωt
Волны со скоростью v распространяются от источника в среде. Частицы среды повторяют колебания источника, но с запозданием по времени тем большим, чем дальше частица находится от источника колебаний. Если источник направляет колебания в одну сторону (плоский), то уравнение волны примет вид
 ,
,
где V – скорость волны в среде, y - расстояние от источника колебаний до колеблющейся частицы.
Это уравнение можно записать в виде
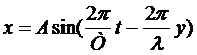
Обозначим 2π/λ = k, эта величина называется волновым числом. Тогда получим следующее уравнение
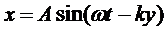
которое называется уравнением плоской одномерной волны и определяет смещение любой точки среды, находящейся на расстоянии y от излучателя в данный момент.
Величина (ωt – ky) называется фазой волны. Зафиксируем какое-либо значение фазы, положив ее постоянной для данной точки  = cons. Это выражение дает связь между временем t и координатой х, в которой зафиксированное значение фазы осуществляется в данный момент. Определив
= cons. Это выражение дает связь между временем t и координатой х, в которой зафиксированное значение фазы осуществляется в данный момент. Определив  , мы найдем скорость, с которой перемещается данное значение фазы. Дифференцируя это соотношение, получим
, мы найдем скорость, с которой перемещается данное значение фазы. Дифференцируя это соотношение, получим  , откуда
, откуда 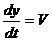 .
.
Таким образом, скорость распространения волны V в уравнении волны есть скорость перемещения фазы, поэтому ее называют фазовой скоростью.
Геометрическое место точек, колеблющихся в одной фазе, называется волновой поверхностью. Волновая поверхность, отделяющая часть пространства, в которой колебания происходят, от той части, где еще нет колебаний, называется фронтом волны. Именно фронт волны перемещается со скоростью равной фазовой скорости волны.
Если источник колебаний точечный, то от него распространяется волна во все стороны и фронт волны имеет вид сферы. Вблизи источника уравнение волны имеет вид
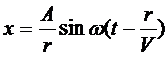 ,
,
где r – расстояние от источника колебаний. Амплитуда сферической волны уменьшается при удалении фронта волны от источника колебаний.
Область пространства, участвующая в волновом процессе, обладает дополнительным запасом энергии. Эта энергия доставляется от источника колебаний в различные точки среды самой волны, следовательно, волна переносит энергию. Численное значение вектора плотности потока энергии определяется следующим образом:

где ΔW - энергия, переносимая за время Δt через площадку ΔS, перпендикулярную к направлению переноса энергии. Другими словами, этот вектор численно равен мощности передаваемой через единичную нормальную к направлению распространения энергии площадку. Направление вектора 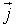 совпадает с направлением распространения энергии волны. Эта величина носит название вектора плотности потока энергии. Вектор плотности потока энергии был впервые определен русским ученым Н.А. Умовым и называется вектором Умова.
совпадает с направлением распространения энергии волны. Эта величина носит название вектора плотности потока энергии. Вектор плотности потока энергии был впервые определен русским ученым Н.А. Умовым и называется вектором Умова.
Среднее по времени значение плотности потока энергии равно:
 ,
,
где ρ – плотность среды.
2. Когда две одинаковые волны с равными амплитудами и периодами распространяются навстречу друг другу, то при их наложении возникают стоячие волны. Стоячие волны могут быть получены при отражении от препятствий. Допустим, излучатель посылает волну к препятствию (падающая волна). Отраженная от него волна наложится на падающую волну. Уравнение стоячей волны можно получить сложением уравнения падающей волны

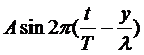
и уравнения отраженной волны 
Отраженная волна движется в направлении, противоположном падающей волне, поэтому расстояние х берем со знаком минус. Смещение точки, которая участвует одновременно в двух колебаниях, равно алгебраической сумме х=х1+х2. После несложных преобразований, получаем

Это уравнение стоячей волны определяет смещение любой точки волны.
Величина 
 не зависит от времени и определяет амплитуду любой точки с координатой y. Каждая точка совершает гармоническое колебание с периодом Т. Амплитуда Аст для каждой точки вполне определена. Но при переходе от одной точки волны к другой она изменяется в зависимости от расстояния y. Если придавать y значения, равные
не зависит от времени и определяет амплитуду любой точки с координатой y. Каждая точка совершает гармоническое колебание с периодом Т. Амплитуда Аст для каждой точки вполне определена. Но при переходе от одной точки волны к другой она изменяется в зависимости от расстояния y. Если придавать y значения, равные  и т.д., то получим
и т.д., то получим  . Следовательно, указанные точки волны остаются в покое, т.к. амплитуды их колебаний равны нулю. Эти точки называются узлами стоячей волны. Точки, в которых колебания происходят с максимальной амплитудой, называются пучностями.
. Следовательно, указанные точки волны остаются в покое, т.к. амплитуды их колебаний равны нулю. Эти точки называются узлами стоячей волны. Точки, в которых колебания происходят с максимальной амплитудой, называются пучностями.
х
Расстояние между соседними узлами (или пучностями) называются длиной стоячей волны и равно λ/2 = λст, где λ - длина бегущей волны.
В стоячей волне все точки среды, в которой они распространяются, расположенные между двумя соседними узлами, колеблются в одной фазе. Точки среды, лежащие по разные стороны от узла, колеблются в противофазе -фазы их отличаются на π. т.е. при переходе через узел фаза колебаний скачкообразно меняется на π. В отличие от бегущих волн в стоячей волне отсутствует перенос энергии вследствие того, что образующие эту волну прямая и обратная волны переносят энергию в равных количествах и в прямом и в противоположном направлениях. В том случае, когда волна отражается от среды более плотной, чем та среда, где распространяется волна, в месте отражения возникает узел, фаза изменяется на противоположную. При этом говорят, что происходит потеря половины волны. Когда волна отражается от среды менее плотной в месте отражения, появляется пучность, и потери половины волны нет.
3. 3. Механические колебания в упругих средах вызывают распространение упругих волн, называемых акустическими колебаниями. Физическое понятие об акустических колебаниях охватывает слышимые и неслышимые колебания упругих сред. Распространяясь в пространстве, звуковые колебания создают акустическое поле.
Звуковыми (или акустическими) волнами называются распространяющиеся в среде упругие волны, обладающие частотами в пределах 16—20000 Гц. Волны указанных частот, воздействуя на слуховой аппарат человека, вызывают ощущение звука. Волны с < 16 Гц (инфразвуковые) и > 20 кГц (ультразвуковые) органами слуха человека не воспринимаются. Наиболее чувствительно человеческое ухо к диапазону звуковых волн от 1000 до 3000 Гц.
Звуковые волны в газах и жидкостях могут быть только продольными, так как эти среды обладают упругостью лишь по отношению к деформациям сжатия (растяжения). В твердых телах звуковые волны могут быть как продольными, так и поперечными, так как твердые тела обладают упругостью по отношению к деформациям сжатия (растяжения) и сдвига.
Интенсивностью звука (или силой звука) называется величина, определяемая средней по времени энергией, переносимой звуковой волной в единицу времени сквозь единичную площадку, перпендикулярную направлению распространения волны:

Единица интенсивности звука в СИ — ватт на метр в квадрате (Вт/м2).
Чувствительность человеческого уха различна для разных частот. Для того чтобы вызвать звуковое ощущение, волна должна обладать некоторой минимальной интенсивностью, но если эта интенсивность превышает определенный предел, то звук не слышен и вызывает только болевое ощущение. Таким образом, для каждой частоты колебаний существуют наименьшая (порог слышимости) и наибольшая (порог болевого ощущения) интенсивности звука, которые способны вызвать звуковое восприятие.
Звуковое давление человек субъективно воспринимает как громкость звука.
Увеличению громкости в 2 раза соответствует увеличение звукового давления в 10 раз (мощности в 100 раз), увеличению громкости в 3 раза соответствует увеличение звукового давления в 100 раз (мощности в 10 000 раз) и т.д. Таким образом, в психоакустическом восприятии звука наблюдается логарифмическая зависимость, что делает удобным использование относительных единиц – децибел. Один децибел - это минимальное изменение уровня звукового сигнала, которое способен воспринять слух человека.
Разница между минимальным и максимальным уровнями различимых звуковых ощущений называется динамическим диапазоном слуха, который составляет приблизительно 120дБ. Болевой порог соответствует звуковому давлению 200Па (на частоте 1кГц).
Звук характеризуется помимо громкости еще высотой и тембром. Высота звука — качество звука, определяемое человеком субъективно на слух и зависящее от частоты звука. С ростом частоты высота звука увеличивается, т. е. звук становится «выше». Характер акустического спектра и распределения энергии между определенными частотами определяет своеобразие звукового ощущения, называемое тембром звука. Так, различные певцы, берущие одну и ту же ноту, имеют различный акустический спектр, т. е. их голоса имеют различный тембр.
Скорость распространения звуковых волн в газах вычисляется по формуле

где R — молярная газовая постоянная, М — молярная масса, =Ср/СV — отношение молярных теплоемкостей газа при постоянных давлении и объеме, Т —термодинамическая температура. Из формулы вытекает, что скорость звука в газе не зависит от давления р газа, но возрастает с повышением температуры. Чем больше молярная масса газа, тем меньше в нем скорость звука. Например, при T=273 К скорость звука в воздухе (M=2910–3 кг/моль) v=331 м/с, в водороде (M=210–3 кг/моль) v=1260 м/с.
Инфразвук (ИЗ) — колебания частотой ниже 20 Гц. Подавляющее число современных людей не слышат акустические колебания частотой ниже 40 Гц. Максимальные уровни низкочастотных акустических колебаний от промышленных и транспортных источников достигают 100–110 дБ.
Допустимыми уровнями звукового давления являются 105 дБ в октавных полосах 2, 4, 8, 16 Гц и 102 дБ в октавной полосе 31.5 Гц. Инфразвук может вселить в человека такие чувства как тоска, панический страх, ощущение холода, беспокойство, дрожь в позвоночнике. Люди, подвергшиеся воздействию инфразвука, испытывают примерно те же ощущения, что и при посещении мест, где происходили встречи с призраками. Попадая в резонанс с биоритмами человека, инфразвук особо высокой интенсивности может вызвать мгновенную смерть.
При совпадении частот внутренних органов и инфразвука, соответствующие органы начинают вибрировать, что может сопровождаться сильнейшими болевыми ощущениями. При воздействии на человека инфразвука с частотами, близкими к 6 Гц, могут отличаться друг от друга картины, создаваемые левым и правым глазом, начнет «ломаться» горизонт, возникнут проблемы с ориентацией в пространстве, придут необъяснимая тревога, страх. Подобные ощущения вызывают и пульсации света на частотах 4–8 Гц. Инфразвук может действовать не только на зрение, но и на психику, а также шевелить волоски на коже, создавая ощущение холода
УЛЬТРАЗВУК (УЗ) — упругие волны с частотой колебаний от 20 кГц до 1 ГГц, не слышимые человеческим ухом. Ультразвуковые волны по своей природе не отличаются от упругих волн слышимого диапазона. Распространение УЗ подчиняется основным законам, общим для акустических волн любого диапазона частот. Вместе с тем высокая частота ультразвуковых колебаний и малая длина волн обусловливают ряд специфических свойств, присущих только УЗ. Вследствие большой частоты (малой длины волны) ультразвук обладает особыми свойствами. Так, подобно свету, ультразвуковые волны могут образовывать строго направленные пучки. Отражение и преломление этих пучков на границе двух сред подчиняется законам геометрической оптики. Он сильно поглощается газами и слабо - жидкостями., отражается от границ раздела твердых и жидких сред с газами.
Ультразвуковые колебания возникают при работе моторов автомобилей, станков и ракетных двигателей. В практике для получения ультразвука обычно применяют электромеханические генераторы ультразвука, действие которых основано на способности некоторых материалов изменять свои размеры под действием магнитного (магнитострикционные генераторы) или электрического поля (пьезоэлектрические генераторы), при этом генераторы издают звуки высокой частоты.
В жидкости под воздействием ультразвука образуются пустоты в виде мельчайших пузырьков с кратковременным возрастанием давления внутри них. Кроме того, ультразвуковые волны ускоряют протекание процессов диффузии (взаимопроникновения двух сред друг в друга). Ультразвуковые волны существенно влияют на растворимость вещества и в целом на ход химических реакций. Эти свойства ультразвука и особенности его взаимодействия со средой обусловливают его широкое техническое и медицинское использование. Ультразвук применяют в медицине и биологии для диагностики, для выявления и лечения опухолей и некоторых дефектов в тканях организма.
У. широко применяется в технике. По данным измерений с и a во многих техн. задачах осуществляется контроль за протеканием того или иного процесса (контроль концентрации смеси газов, состава разл. жидкостей и т. п.). Используя отражение У. на границе разл. сред, с помощью УЗ-приборов измеряют размеры изделий (напр., УЗ-тол-щиномеры), определяют уровни жидкостей в ёмкостях, недоступных для прямого измерения. У. сравнительно малой интенсивности (~0,1 Вт/см2) применяется в дефектоскопии для неразрушающего контроля изделий из твёрдых материалов (рельсов, крупных отливок, качественного проката и т. д.). При помощи У. осуществляется звукови-дение: преобразуя УЗ-колебания в электрические, а последние в световые, оказывается возможным при помощи У. видеть те или иные предметы в непрозрачной для света среде. Для получения увеличенных изображений предмета с помощью У. высокой частоты создан акустич. микроскоп, аналогичный обычному микроскопу, преимущества к-рого перед оптическим - высокая контрастность и возможность получать изображения оптически непрозрачных объектов.
Лекция 8
Тема: Основы молекулярно-кинетической теории
Вопросы: 1) Статистический метод в физике
2) Основное уравнение молекулярно-кинетической теории
3) Внутренняя энергия газа
4) Явления переноса
1. Молекулярная физика и термодинамика - разделы физики, в которых изучается макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статический (молекулярно-кинетический) и термодинамический. В основе молекулярной физики лежит статический метод
Молекулярная физика раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Движение молекул в разных телах происходит по-разному. Молекулы газов беспорядочно движутся с большими скоростями (сотни м/с) по всему объему газа. Сталкиваясь, они отскакивают друг от друга, изменяя величину и направление скоростей. Молекулы жидкости колеблются около равновесных положений (т.к. расположены почти вплотную друг к другу) и сравнительно редко перескакивают из одного равновесного положения в другое случайным образом. Движение молекул в жидкостях является менее свободным, чем в газах, но более свободным, чем в твердых телах. В твердых телах частицы сильно связаны, поэтому только колеблются около положения равновесия. Между ними действуют силы притяжения и отталкивания (см. рис.).
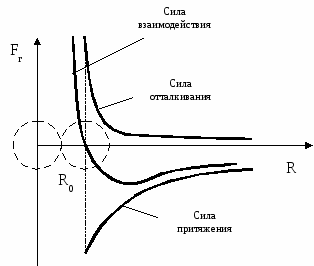
При образовании кристалла из раствора или расплава молекулы (атомы, ионы) занимают положения, в которых эти силы уравновешивают друг друга (расстояние R0) между частицами.
С ростом температуры скорость частиц увеличивается, поэтому хаотическое движение частиц принято называть тепловым.
Модель идеального газа – твёрдые шарики одного диаметра, взаимодействующие между собой только при столкновении. В момент столкновения молекула резко изменяет величину и направление скорости своего движения. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега.
Скорости молекул газа имеют различные значения и направления, причем из-за огромного числа соударений, которые ежесекундно испытывает молекула, скорость ее постоянно изменяется. В этом случае не имеет смысла применять динамический метод, основанный на законах Ньютона - нельзя определить число молекул, которые обладают точно заданной скоростью v в данный момент времени. Максвелл разработал статистический метод, по которому можно подсчитать долю молекул, скорости которых имеют значение, лежащие между некоторыми скоростями v 1 и v 2. На основании теории вероятности Максвелл установил закономерность (функцию f(v)), по которой можно определить долю от общего числа молекул газа N, скорости которых при данной температуре заключены в интервале скоростей от v до v + dv:

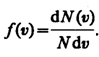
, где
Видно, что конкретный вид функции зависит от рода газа (от массы молекулы m0) и от параметра состояния (температуры Т). В формуле k – постоянная Больцмана, равная 1, 38·10 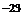 Дж/К.
Дж/К.
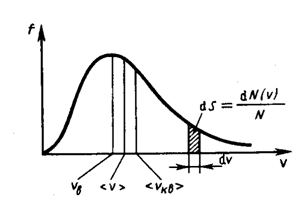
Распределение Максвелла достигает максимума при наиболее вероятной скорости  , т.е. такой скорости, к которой близки скорости большинства молекул. Здесь m – масса одной молекулы газа.
, т.е. такой скорости, к которой близки скорости большинства молекул. Здесь m – масса одной молекулы газа.
Площадь заштрихованной полоски с основанием dV покажет, какая часть от общего числа молекул имеет скорости, лежащие в данном интервале. Конкретный вид функции распределения Максвелла зависит от рода газа (массы молекулы) и температуры. Давление и объем газа на распределение молекул по скоростям не влияет. С повышением температуры наиболее вероятная скорость возрастает, поэтому максимум распределения молекул по скоростям сдвигается в сторону больших скоростей, а его абсолютная величина уменьшается, т.к. общее число молекул (площадь под кривой) не изменяется (см. рисунок ниже).

Следовательно, при нагревании газа доля молекул, обладающих малыми скоростями уменьшается, а доля молекул с большими скоростями увеличивается.
Таким образом, в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Из него вытекает также, что как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой т 0 в газе, находящемся в состоянии равновесия при Т = const. остается постоянной и равной 
Распределение Максвелла позволяет найти среднюю арифметическую скорость молекул:
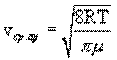 .
.
При комнатной температуре T=300K средняя арифметическая скорость молекул кислорода будет равна ≈500 м/с.
Первое экспериментальное определение скоростей молекул было осуществлено Штерном в 1920 г: подтвердилась правильность оценки средней скорости молекул, вытекающей из распределения Максвелла.
Экспериментальная установка представляет собой два находящихся в вакууме жестко связанных между собой коаксиальных цилиндра (см. рис.), по оси которых натянута платиновая нить, покрытая серебром. Малый цилиндр радиуса r имеет вертикальную щель.
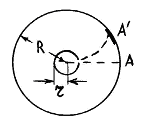

Если по нити пропустить электрический ток, она будет нагреваться, серебро будет испарятся, его атомы будут пролетать через щель и осаждаться на большом цилиндре радиуса R, образуя изображение узкой щели в виде узкой полоски почернения серебра. Картина изменится, если установку привести во вращение с угловой скоростью w, при этом полоска смещается в сторону противоположную вращению на величину  =AA'. Смещение возникало, потому что за время t пролета атомом серебра расстояния R-r цилиндр успевал повернуться на угол
=AA'. Смещение возникало, потому что за время t пролета атомом серебра расстояния R-r цилиндр успевал повернуться на угол  =
=  /R =
/R =  t. Откуда определялось время t =
t. Откуда определялось время t =  /
/  R, знание которого позволяло найти скорость атома серебра через измеримые параметры опыта:
R, знание которого позволяло найти скорость атома серебра через измеримые параметры опыта:

Как следовало ожидать, полоска серебра в положении А' оказывалась размытой из-за того, что атомы серебра имеют разные скорости: более быстрым атомам соответствуют меньшие, а более медленным – большие смещения  . Исследуя зависимость плотности серебра в размытой части от расстояния до точки A, нетрудно оценить распределение атомов серебра по скоростям. Полученное распределение хорошо согласовывалось со значениями, вычисленными по формуле Максвелла.
. Исследуя зависимость плотности серебра в размытой части от расстояния до точки A, нетрудно оценить распределение атомов серебра по скоростям. Полученное распределение хорошо согласовывалось со значениями, вычисленными по формуле Максвелла.
Применяя статистический метод, Больцман получил распределение молекул газа в гравитационном поле:
 ,
,
где n – число молекул газа в единице объема (концентрация) на высоте h, n0 – концентрация молекул газа на нулевом уровне (уровне земли)
Больцман показал, что полученное распределение применимо к идеальному газу, находящемуся в любом силовом поле.
2. Результаты экспериментальных и теоретических исследований позволили уже в девятнадцатом веке сформулировать основные положения молекулярно-кинетической теории для газов:
· газ состоит из молекул (мельчайших частиц, размеры которых порядка 10-10 м);
· молекулы газа находятся в непрерывном хаотическом движении;
· молекулы сталкиваются друг с другом. Столкновения бывают упругими (низкие температуры) и неупругими (высокие температуры);
· в промежутке между соударениями молекулы движутся прямолинейно;
· молекулы на малых расстояниях отталкиваются, а на больших притягиваются друг к другу.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В модели идеального газа предполагается следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
При упругом столкновении молекулы со стенкой сосуда проекция vх вектора скорости на ось ОХ, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (см.рис).

Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось ОХ изменяется от mv1х = - mvх до mv2х = mvх. Изменение импульса молекулы показывает, что на нее при столкновении действует сила  , направленная от стенки. Изменение импульса молекулы равно импульсу силы:
, направленная от стенки. Изменение импульса молекулы равно импульсу силы:
 .
.
Во время столкновения молекула действует на стенку с силой 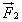 , равной по третьему закону Ньютона силе
, равной по третьему закону Ньютона силе  по модулю и направленной противоположно.
по модулю и направленной противоположно.
Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление газа равно отношению модуля силы давления  к площади стенки S:
к площади стенки S:
 .
.
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяет вычислить давление газа, если известны масса m молекулы газа, среднее значение квадрата скорости молекул  и концентрация n молекул:
и концентрация n молекул:

Среднее значение кинетической энергии молекул идеального газа
 , получим
, получим  .
.
Давление идеального газа равно двум третям средней кинетической энергии движения молекул, содержащихся в единице объема.
Опыт показывает, что давление и температура газа связаны, поэтому английским физиком Кельвином была введена абсолютная температура Т как мера средней энергии движения молекул вещества:

Здесь k - постоянная Больцмана, k = 1,38*10-23 Дж/К. За ноль абсолютной температуры принята такая температура по шкале Кельвина, при которой прекращается всякое движение молекул вещества, т.е.  .
.
Связь температур, измеряемых в шкале Кельвина Т и шкале Цельсия t, имеет вид
Т = t + 273.
В результате было получено выражение, связывающее давление и температуру идеального газа
p= nkT,
которое называется основным уравнением молекулярно-кинетической теории газа.
В результате преобразования этого выражения было получено уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
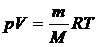 ,
,
где универсальная газовая постоянная R = 8,31 Дж/(моль·К), М - молярная масса газа, m – масса газа, V – объем газа.
Основной закон молекулярно-кинетической теории позволил рассчитать среднюю длину свободного пробега молекул газа между соударениями

r– размер молекулы, n – число молекул в единице объема газа.
В воздухе при нормальных условиях (давление 1 атм, температура 273 К) средняя длина свободного пробега молекулы составляет порядка 0,6 ·10  м, при этом в единице объема газа каждую секунду совершается порядка 8,6·10
м, при этом в единице объема газа каждую секунду совершается порядка 8,6·10  столкновений молекул.
столкновений молекул.
3. Молекулы можно рассматривать как системы материальных точек (атомов) совершающих как поступательное, так и вращательное движения. При исследовании движения тела необходимо знать его положение относительно выбранной системы координат. Для этого вводится понятие о степенях свободы тела. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела.
При движении точки по прямой линии для оценки ее положения необходимо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движения по плоскости, ее положение характеризуется двумя координатами; при этом точка обладает двумя степенями свободы. Положение точки в пространстве определяется 3 координатами. Число степеней свободы обычно обозначают буквой i. Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий).
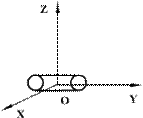
Двухатомные жесткие молекулы, например молекулы водорода, азота и др., обладают пятью степенями свободы: они имеют 3 степени свободы поступательного движения и 2 степени свободы вращения вокруг осей ОХ и OZ (см.рис.). Вращением вокруг оси OY можно пренебречь, т.к. момент инерции ее относительно этой оси пренебрежимо мал. Поэтому вклад энергии вращательного движения вокруг оси OY в суммарную энергию двухатомной молекулы можно не учитывать.
Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой, имеют число степеней свободы i = 6: три степени свободы поступательного движения и 3 степени свободы вращения вокруг осей ОХ, OY и OZ.
В случае, если расстояние между атомами может изменяться (атомы совершают колебания у положения равновесия), появляются дополнительные степени свободы. Согласно молекулярно-кинетической теории газов движение молекул носит беспорядочный характер; эта беспорядочность относится ко всем видам движения молекулы. Ни один из видов движения не имеет преимущества перед другим. При статистическом равновесии движений энергия в среднем распределяется равномерно между всеми видами движения. Закон равномерного распределения энергии по степеням свободы молекул можно сформулировать следующим образом: статистически в среднем на каждую степень свободы молекул приходится одинаковая энергия.
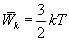 . Поступательное движение молекул характеризуется средней кинетической энергией, равной
. Поступательное движение молекул характеризуется средней кинетической энергией, равной
Так как поступательному движению соответствует 3 степени свободы, то в среднем на одну степень свободы движения молекул приходится энергия
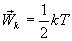
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной

В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией хаотического (теплового) движения всех его молекул.
Так как в одном моле любого вещества содержится NА (число Авогадро
 ) молекул, то внутренняя энергия одного моля газа будет
) молекул, то внутренняя энергия одного моля газа будет

 Учитывая, что получим
Учитывая, что получим 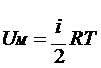 , здесь R=8,31 Дж/(моль·К) – универсальная газовая постоянная.
, здесь R=8,31 Дж/(моль·К) – универсальная газовая постоянная.
Для любой массы m газа с молярной массой М, т.е. для любого числа молей формула для внутренней энергии имеет вид

Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю.
4. Беспорядочное тепловое движение молекул, непрерывные столкновения между ними приводят к тому, что молекулы, хотя и сравнительно медленно, перемещаются из одной точки пространства в другую. В результате столкновения изменяются величины и направления скоростей молекул, что приводит к передаче импульса и энергии. По этой причине в газовой среде, если рассматривать бесконечно малые объемы отдельных участков среды, самопроизвольно возникают флуктуации плотности (концентрации), температуры и давления газа, которые мгновенно исчезают. Если данные неоднородности вызваны посторонним источником и носят постоянный характер, то хаотическое движение молекул стремится ликвидировать эти неоднородности. При этом в газе возникают особые процессы, которые носят название явлений переноса. К ним относятся диффузия, теплопроводность и внутреннее трение.
 Диффузия. Если в локальном объеме распределена примесь другого газа (или увеличена плотность данного газа), то хаотическое движение молекул будет способствовать выравниванию концентрации газовых молекул. Процесс выравнивания концентрации газовых молекул называется диффузией. Наблюдения показывают, что в процессе диффузии через площадь поверхности
Диффузия. Если в локальном объеме распределена примесь другого газа (или увеличена плотность данного газа), то хаотическое движение молекул будет способствовать выравниванию концентрации газовых молекул. Процесс выравнивания концентрации газовых молекул называется диффузией. Наблюдения показывают, что в процессе диффузии через площадь поверхности  , расположенную нормально оси, вдоль которой происходит изменение концентрации вещества за время
, расположенную нормально оси, вдоль которой происходит изменение концентрации вещества за время  , переносится масса вещества
, переносится масса вещества  , пропорциональная градиенту концентрации
, пропорциональная градиенту концентрации  , площади
, площади 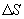 и времени
и времени 
Это уравнение выражает закон Фика. Величина D называется коэффициентом диффузии. Знак минус означает, что масса переносится в сторону убывания концентрации. С точки зрения молекулярно-кинетической теории

Таким образом, коэффициент диффузии определяется средней длиной свободного пробега  и средней арифметической скоростью
и средней арифметической скоростью  молекул.
молекул.
Теплопроводность. В случае неодинаковых температур в различных частях газа те молекулы, которые находятся в более теплых областях, в среднем обладают большей кинетической энергией, чем молекулы в более холодных областях. И здесь молекулярное движение сопровождается суммарным переносом энергии в направлении более холодных частей газа, вследствие чего происходит выравнивание температуры. Этот процесс называется теплопроводностью. Явление теплопроводности заключается в переносе теплоты  от более горячего слоя с температурой
от более горячего слоя с температурой  к более холодному, температура которого
к более холодному, температура которого  , Закон теплопроводности был сформулирован Фурье: теплота
, Закон теплопроводности был сформулирован Фурье: теплота  переносимая через элемент площади
переносимая через элемент площади 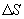 за время
за время  , пропорциональна градиенту температуры
, пропорциональна градиенту температуры  , площади
, площади 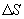 и времени
и времени  :
:

где χ - коэффициент теплопроводности, он зависит от среднеарифметической скорости молекул и плотности газа (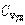 - удельная теплоемкость газа):
- удельная теплоемкость газа):

Внутреннее трение. Если два соприкасающихся слоя движутся с различными скоростями, то может происходить выравнивание скоростей слоев газов. В среднем импульсы молекул таких слоев различны - молекулы более быстрых слоев имеют большие значения импульсов. Переход молекул из быстрых слоев в более медленный сопровождается переносом импульса упорядоченного движения. Противоположное по характеру действие оказывают молекулы медленного слоя, перешедшие в быстрый слой, - в этом слое возникают тормозящие силы. Суммарный эффект при этом - выравнивание скоростей слоев. Это явление называется внутренним трением. При этом закон внутреннего трения гласит: сила вязкости F пропорциональна градиенту скорости  и площади S соприкасающихся слоев:
и площади S соприкасающихся слоев:

где η - коэффициент внутреннего трения (динамическая вязкость). С точки зрения молекулярно-кинетической теории

Лекция 9
Тема: Законы термодинамики
Вопросы: 1) Первый закон термодинамики
2) Применение первого закона термодинамики к газовым
процессам
3) Второй закон термодинамики
4) Статистический смысл энтропии
5) Круговые процессы. Цикл Карно
1. Термодинамическое состояние тела (например, газа) характеризуется его массой m, молярной массой М, давлением P, объемом V, температурой T. Все эти величины называются термодинамическими параметрами тела. Однако, такие параметры, как P, V, T, имеют смысл только тогда, когда тело находится, хотя бы приближенно, в так называемом состоянии термодинамического равновесия. Так называется состояние, в котором все термодинамические параметры остаются со временем постоянными. Не имеет смысла, например, говорить о температуре газа до тех пор, пока быстрые молекулы у горячей стенки сосуда, вследствие ряда столкновений с другими, не приобретут скоростей порядка средней скорости остальных молекул, иначе говоря, пока система не придет в состояние равновесия. В состоянии т.д.р. для каждого вещества термодинамические параметры связаны между собой уравнением состояния.
Рассмотрим газ, находящийся в цилиндре с поршнем, позволяющем менять объем газа (см. рис).

Цилиндр контактирует с нагревателем, который может сообщать газу тепло. Пусть на поршень оказывается внешнее давление, величина которого может быть любой.
Все процессы, которые будем рассматривать ниже, будут квазистатическими, т.е. медленными настолько, чтобы можно было считать, что в каждый момент газ находится в состоянии т.д.р. Если очень быстро сжать газ, то давление его у поршня окажется на какой-то момент больше, чем в стальном объеме, и тогда нельзя будет говорить о давлении газа вообще. Такой процесс не является квазистатическим. Приближенно квазистатическими являются и процессы, достаточно быстрые с технической точки зрения, например процессы, происходящих в цилиндрах двигателя автомашины во время работы мотора (оказывается, для приближенной квазистатичности требуется, чтобы скорость поршня была мала по сравнению со скоростью звука в газе).
Работа над газом выполняется внешними силами при его сжатии. Работа самого газа выполняется при его расширении. Пусть газ расширяется так, что поршень поднимается на величину dx. Тогда газ выполнит работу dA=Fdx. Так как P=F/S (S – площадь поршня), то получим dA= P S dx = PdV/
Эта величина называется элементарной работой газа. Работа при расширении газа от объема V1 до V2 будет равна

Если по одной оси отложить объем газа, по другой – его давление (плоскость P – V), то работа будет изображаться площадью под кривой P(V) (рис.9.3).

Процесс расширения от объема V1 до объема V2 может происходить различным образом: например, можно при этом изолировать газ от нагревателя или, наоборот, нагревать газ и т.д. Иначе говоря, при перемещении из точки 1 в точку 2 в газе могут происходить различные процессы, даже если зафиксировано начальное и конечное состояния. В каждом процессе работа будет иметь свое значение, так как площадь под кривой процесса будет различной (кривые I, II, и III на рис/). Таким образом, выполняемая газом работа зависит от процесса, который с ним происходит.
Работа положительна, если она выполняется газом, и отрицательна, если внешние силы выполняют ее над газом.
Первый закон термодинамики: теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил:
ΔQ=ΔU+ΔA
Первый закон термодинамики представляет собой закон сохранения энергии.
Под внутренней энергией (U) понимается вся энергия системы за исключением механической энергии системы как целого. Сюда входит кинетическая энергия поступательного движения ее молекул, потенциальная энергия их взаимодействия между собой, энергия возбуждения колебаний и вращений молекул, то есть те виды энергии системы, которые могут меняться в термодинамических процессах. Внутренняя энергия идеального газа складывается только из кинетической энергии поступательного и вращательного движения его молекул (взаимодействие молекул незначительно).
 В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости. Теплоемкость тела - количество теплоты необходимое для нагревания тела на один Кельвин
В термодинамике для характеристики тепловых свойств тел используется понятие теплоемкости. Теплоемкость тела - количество теплоты необходимое для нагревания тела на один Кельвин
Удельной теплоемкостью называется величина, числено равная теплоте, которую надо сообщить единице массы тела для повышения его температуры на один Кельвин:

Отсюда можно определить количество теплоты, необходимое для нагревания вещества, массы m: ΔQ = cmΔT
Молярная теплоемкость - количество тепла необходимое для нагревания одного моля вещества на один Кельвин

2. Изобарный процесс протекает при постоянном давлении (Р = const), например, при нагревании газа в цилиндре под свободно перемещающимся поршнем.
Из уравнения состояния идеального газа следует, что при р = const, m = const, M = const
V / T = const
Графики, отображающие этот процесс, называют изобарами (см.рис.)

Работа системы при изменении объема от V1 до V2 определяется по площади под графиков в координатах P-V

А= Р(V2 - V1)
Следовательно, теплота, переданная газу при изобарическом процессе, затрачивается на увеличение его внутренней энергии и совершение работы:
ΔQ=ΔU+ рΔ V
Изохорный процесс протекает при постоянном объеме (V = const), например, при нагревании газа в закрытом сосуде. Из уравнения состояния идеального газа следует, что при V = const, m = const, M = const
Р / T = const
Графики, отображающие этот процесс, называют изохорами (см.рис.).

При изохорическом процессе работа не совершается (площадь под графиком в координатах P-V равна 0).

А= рΔ V =0 и первое начало термодинамики приобретает вид: ΔQ=ΔU,
т.е. при изохорическом процессе вся подводимая к газу теплота затрачивается на увеличение внутренней энергии системы.
Изотермический процесс протекает при постоянной температуре (Т = const). Из уравнения состояния идеального газа следует, что при Т = const, m=const, M = const
P·V = const
Кривые, отображающие этот процесс, называют изотермами (см. рис.)

При изотермическом процессе (Т= const) ΔT=0 и изменение внутренней энергии ΔU=0. Согласно первому закону термодинамики теплота, передаваемая газу, полностью затрачивается на внешнюю работу: ΔQ = ΔA

Работа системы численно равны площади под графиком процесса в координатах P-V Аналитическое выражение для работы следующие:

Определим из уравнения Менделеева – Клапейрона Р:

и подставим в уравнение работы

Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы.
Так как передачи теплоты при адиабатическом процессе не происходит, то ΔQ и уравнение I начала термодинамики принимает вид
ΔU+ΔA = 0 или ΔA = -ΔU. т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии.
Адиабатное расширение газа (ΔV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (ΔT<0).
Сжатие газа (ΔV<0) совершается при воздействии внешних сил; в этом случае работа отрицательна и ΔT>0. Адиабатное сжатие газа сопровождается его нагреванием.
Адиабатический процесс описывается уравнением Пуассона 

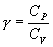
где СV – молярная теплоемкость газа при постоянном объеме
Ср –молярная теплоемкость газа при постоянном давлении, Ср = СV+R.
Линию, изображающую адиабатический процесс в диаграмме состояния, называют адиабатой. На рисунке ниже сплошной линией показан вид адиабаты в (P-V) диаграмме. Для сравнения в том же рисунке пунктирной линией изображена изотерма, соответствующая температуре газа в начальном состоянии. Так как для любого идеального газа показатель адиабаты γ>1, то в (P-V) диаграмме адиабата всегда идет круче, чем изотерма. Объясняется это тем, что при адиабатическом сжатии увеличение давления обусловлено не только уменьшением объема газа, как при изотермическом сжатии, то также еще и увеличения температуры. При адиабатическом расширении температура газа уменьшается, поэтому давление газа падает быстрее, чем при изотермическом расширении.

Работа, совершаемая газом в адиабатическом процессе



Поэтому
3. Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. После протекания обратимого процесса в одном, а затем в обратном направлении и возвращение системы в первоначальное состояние в окружающих телах не должно оставаться никаких изменений. Например шарик на пружине в вакууме колеблется бесконечно долго.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
Выражая всеобщий закон сохранения и превращения энергии, первый закон термодинамики не позволяет определить направление протекания процесса. В самом деле, процесс самопроизвольной передачи энергии в форме теплоты от холодного тела к горячему ни в какой мере не противоречит первому закону термодинамики. Однако при опускании раскаленного куска железа в холодную воду никогда не наблюдается явление дальнейшего нагревания железа за счет соответствующего охлаждения воды. Далее, первый закон не исключает возможности такого процесса, единственным результатом которого было бы превращение теплоты, полученной от нагревателя в эквивалентную ей работу. Так, например основываясь на первом законе можно было бы попытаться построить периодически действующий двигатель, совершающий работу за счет одного источника тепла (например за счет внутренней энергии океана). Такой двигатель называется вечным двигателем второго рода. Обобщение огромного экспериментального материала привело к выводу о невозможности построения вечного двигателя второго рода. Этот вывод получил название второго начала термодинамики.
Существует ряд различных по форме, одинаковых по существу формулировок второго начала. Удобно процессы, протекающие в термодинамических системах, описывать с помощью энтропии. Понятие энтропии S было впервые введено в 1865 году Рудольфом Клаузиусом при рассмотрении работы тепловой машины, однако смысл его был раскрыт позже Больцманом.
Принцип существования энтропии: система может быть переведена из состояния 1 (с параметрами Р1, V1, T1) в состояние 2 (с параметрами Р2, V2, T2) множеством способов, но при этом одинаковым остается изменение энтропии

где dQ – количество тепла, полученное системой, а Т – температура системы.
Разность энтропий в двух равновесных состояниях 2 и 1 системы равна приведенному количеству тепла, которое нужно сообщить системе, чтобы перевести ее из состояния 1 в состояние 2.
. В случае обратимого процесса

Интеграл по замкнутому контуру - это изменение энтропии во всем цикле, т.е. при обратимых циклах энтропия не меняется: 
Физический смысл имеет не сама энтропия, а ее изменение. Условно энтропию системы при абсолютном нуле принимают равной нулю. Приближенно изменение энтропии можно представить в виде

Рассмотрим изолированную систему, состоящую из двух тел с одинаковой теплоемкостью, но с разными температурами (Т2 >Т1).

В системе возникает необратимый процесс теплопроводности. Теплота переходит от нагретого тела 2 к более холодному телу 1. В конце этого процесса температуры станут равными, переход тепла прекратится, система перейдет в состояние термодинамического равновесия. Изменение энтропии первого тела равно 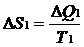 , где Т1 –температура первого тела, ΔQ1 – количество теплоты, полученное первым телом. Изменение энтропии второго тела равно
, где Т1 –температура первого тела, ΔQ1 – количество теплоты, полученное первым телом. Изменение энтропии второго тела равно 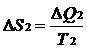 , где Т2 –температура второго тела, ΔQ2 – количество теплоты, отданное вторым телом. Так как система изолированная и других тел нет, то ΔQ1 = - ΔQ2.
, где Т2 –температура второго тела, ΔQ2 – количество теплоты, отданное вторым телом. Так как система изолированная и других тел нет, то ΔQ1 = - ΔQ2.
Общее изменение энтропии системы ΔS = ΔS1 + ΔS2 = 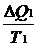 -
-  .
.
Так как Т2 >Т1, то ΔS > 0. Тот же результат получим, если рассмотрим процесс диффузии или необратимые химические реакции.
Второй закон термодинамики: в изолированной системе самопроизвольно могут протекать только те процессы, при которых
происходит увеличение энтропии
Таким образом, энтропия изолированной системы может только возрастать (если в системе протекают необратимые процессы), либо остается постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может. В этом состоит сущность второго закона термодинамики.
В изолированной системе не могут идти процессы, уменьшающие энтропию: теплота не может переходить от холодного тела к более нагретому без дополнительных затрат энергии; газы смешиваются, но не могут сами разделиться и т.д.
4. Смысл понятия энтропии раскрыл Людвиг Больцман с помощью мысленного опыта с молекулами газа.
Пусть в сосуде находятся шесть молекул, которые двигаются хаотически и могут по-разному распределяться в двух половинах сосуда. Распределение 6:0, когда все молекулы собираются в одной половине сосуда реализуется одним способом. Распределение 1:5 реализуется 6 способами (каждая молекула побывает в одной половине сосуда, когда все остальные находятся в другой половине. Распределение 2:4 реализуется 15 способами, распределение 3:3 реализуется 20 способами. Значит, набольшим числом способов реализуется равномерное распределение молекул по объему сосуда, т.е. это состояние наиболее вероятно.
Если в качестве примера взять 12 молекул, то результат еще более убедительный, это видно из приведенной ниже таблицы (верхняя строка – соотношение числа молекул, нижняя – число способов такого распределения)
| 12:0 | 11:1 | 10:2 | 9:3 | 8:4 | 7:5 | 6:6 | 5:7 | 4:8 | 3:9 | 2:10 | 1:11 | 0:12 |
Из этого опыта видно, что наиболее вероятным является такое состояние, в котором равномерно по объему распределены молекулы и их энергии, т.е. состояние термодинамического равновесия. В это состояние в конце концов переходят все изолированные системы и в этом состоянии энтропия максимальна. Больцман установил, что энтропия системы S связана с вероятностью (статистическим весом) состояния системы W соотношением
S = k·ln(W),
где постоянная Больцмана k =1,38·10-23 Дж/К.
Статистический вес состояния системы W экспоненциально растет с ростом S. Иными словами, менее упорядоченное состояние (больший хаос) имеет больший статистический вес, т. к. оно может быть реализовано большим числом способов. Следовательно, энтропия - мера неупорядоченности (беспорядка) системы. Наиболее вероятным состоянием, соответствующим максимуму энтропии, будет равномерное распределение молекул, при этом реализуется и максимальный «беспорядок»
Современная формулировка второго закона термодинамики: все самопроизвольные процессы в природе идут так, что системы переходят из менее вероятного состояния в более вероятное.
| <== предыдущая лекция | | | следующая лекция ==> |
| Контрольные задания | | | 1 страница. Если между двумя электродами в воздухе появляется электрическое поле напряженностью порядка 3·10 В/м |
Не нашли, что искали? Воспользуйтесь поиском: