
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Студент, не предоставивший удовлетворительно выполненную контрольную работу, к экзамену не допускается.
Методические указания по разделам контрольной работы
Основные понятия и стехиометрические законы химии
Прежде чем приступать к решению задач этого раздела, необходимо четко уяснить понятия: относительная атомная и молекулярная массы, формульная масса, моль, постоянная Авогадро, молярная масса, молярный объем, эквивалент, число эквивалентности, количество вещества эквивалента, молярная масса эквивалента. Требуются также знания уравнения состояния идеального газа (уравнение Клапейрона-Менделеева), закона Авогадро и следствий из него, закона Дальтона для парциальных давлений газов, закона эквивалентов. Необходимо уметь выражать связь между массой, молярной массой и количеством вещества, а также связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества. Требуется научиться применять закон эквивалентов для нахождения масс и молярных масс веществ, участвующих или образующихся в реакции, уметь определять эквивалент и молярную массу эквивалента вещества в конкретной реакции.
Так как понятие эквивалента за последние десятилетия претерпело существенное изменение, для его усвоения следует пользоваться современными изданиями учебников.
Химическим эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и ионообменных реакциях, либо одному электрону в окислительно-восстановительных реакциях.
Реальные частицы – это атомы, ионы, молекулы и так далее, а условные частицы – это, например, 1/2 Н2SO4, 1/4 C, 1/3 Fe3+.
В общем случае эквивалент любого вещества X может быть записан в виде 1/z(X), где z – число эквивалентности, или эквивалентное число, которое всегда ³ 1. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества.
Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества. Рассмотрим окислительно-восстановительную реакцию
S + O2 = SO2
S0 - 4e- = S+4
O2 + 4e- = 2O –2.
Формульная единица серы отдает 4 электрона, а одна формульная единица молекулярного кислорода принимает 4 электрона. Следовательно, z для серы и для кислорода равно четырем. Поэтому эквивалент серы в приведенной реакции - условная частица ¼ S, а эквивалент кислорода – ¼ О2.
В ионообменных процессах величина z определяется стехиометрией реакции, причем для одного и того же вещества, в зависимости от реакции, эквивалентное число может иметь различное значение.
В качестве примера рассмотрим две реакции:
H2SO4 + NaOH = NaHSO4 + H2O;
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O.
Эквивалентом гидроксида натрия является реальная частица NaOH, для нее z = 1. В соответствии с уравнением первой реакции, один эквивалент NaOH взаимодействует с одной частицей H2SO4. Поэтому число эквивалентности для серной кислоты в этой реакции равно 1, а эквивалентом будет являться реальная частица H2SO4.
Во второй реакции два эквивалента гидроксида натрия реагируют с одной частицей серной кислоты, тогда один эквивалент NaOH взаимодействует с условной частицей 1/2 H2SO4, которая и будет являться эквивалентом серной кислоты во второй реакции. Таких частиц в формульной единице H2SO4 две, поэтому для серной кислоты в данной реакции z = 2.
Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами:
- для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента;
- для кислот z равно основности кислоты;
- для оснований z равно кислотности основания;
- для солей z равно числу катионов металла, умноженному на заряд катиона.
Количество вещества эквивалента обозначается n(1/z(X)). Единица измерения – моль. 1 Моль эквивалента вещества содержит 6,022×1023 эквивалентов.
Молярная масса эквивалента М(1/z(X))– это масса 1 моль эквивалентавещества 1/z(X), измеряется в г/моль.
Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями
 (2.1.1)
(2.1.1)
Например, молярная масса эквивалента серной кислоты может быть вычислена как M(1/2H2SO4) = M(H2SO4):2 = 98:2 = 49 (г/моль).
Закон эквивалентов гласит: «Эквивалентные количества всех веществ, участвующих в реакции, одинаковы».
n (1/z (X1)) = n (1/z (X2))(2.1.2)
Например, для реакции H2SO4 + 2NaOH = Na2SO4 + 2H2O закон запишется в виде равенств
n(1/2 H2SO4) = n(NaOH) = n(1/2 Na2SO4) = n(H2O)
Из закона эквивалентов следует, что массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы эквивалентов этих веществ.
В общем виде для двух компонентов реакции Х1 и Х2 справедлива формула
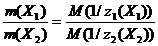 (2.1.3)
(2.1.3)
Если один из компонентов реакции, допустим Х1, находится в газообразном состоянии, то для него справедливы соотношения:
 ;
; 
где V(X) – объем газообразного вещества X;
VM(1/z(X)) – объем, занимаемый одним моль эквивалента вещества Х;
VM(X) – молярный объем газообразного вещества Х, равный при нормальных условиях 22,4 л/моль.
Тогда равенство (2.1.3) преобразуется к виду
 (2.1.4)
(2.1.4)
Приведем другие формулы, использующиеся при решении задач этого раздела.
Молярная масса вещества М:
 , (2.1.5)
, (2.1.5)
где m – масса вещества, г;
n - количество вещества, моль.
Единица измерениямолярной массы – г/моль.
Число Авогадро – число частиц, содержащихся в 1 моль.
NA= 6,02∙1023 моль -1.
Молярный объем VM:
VM = V: n, (2.1.6)
где V - объем газа;
n - количество вещества газа, моль.
При нормальных условиях молярный объем любого газа равен 22,4 л/моль (следствие из закона Авогадро).
Отношение масс равных объемов газов при одинаковых условиях равно отношению их молярных масс (следствие из закона Авогадро):
 (2.1.7)
(2.1.7)
Величина  называется относительной плотностью первого газа по второму.
называется относительной плотностью первого газа по второму.
Закон Дальтона для парциальных давлений не реагирующих друг с другом газов:
Робщ.=Р1+Р2+…+Рn, (2.1.8)
где Робщ – общее давление смеси не реагирующих газов;
Р1, Р2, … Рn – парциальные давления компонентов смеси.
Объединенный газовый закон:
 (2.1.9)
(2.1.9)
Уравнение состояния идеального газа Клапейрона – Менделеева связывает между собой такие величины, как молярная масса газа М, его масса m, давление Р, объем V и температура Т:
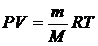 , (2.1.10)
, (2.1.10)
где R – универсальная газовая постоянная, равная 8,314 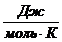 .
.
Пример 1
Определить молярную массу эквивалента Fe2(SO4)3 в реакции
Fe2(SO4)3 + 6 NaOH = 2 Fe(OH)3 + 3 Na2SO4.
Решение
Одна формульная единица гидроксида натрия взаимодействует с одним ионом водорода, поэтому эквивалент щелочи есть реальная частица NaOH. По стехиометрии реакции на одну частицу NaOH (эквивалент) приходится 1/6частицы Fe2(SO4)3, поэтому эквивалентом сульфата железа (III) в данной реакции будет условная частица 1/6 Fe2(SO4)3.
Молярная масса эквивалента сульфата железа (III) в данной реакции может быть вычислена по формуле
M(1/6 Fe2(SO4)3) = M(Fe2(SO4)3) / 6 = 400 / 6 = 66,7 (г/моль).
Пример 2
Хлорид никеля массой 2,918 г взаимодействует с 1,8 г гидроксида натрия, молярная масса эквивалента которого равна 40 г/моль. Вычислить молярную массу эквивалента хлорида никеля.
Решение
В соответствии с законом эквивалентов
m(хлорида) / m(NaOH) = M(1/z хлорида) / M(1/1 NaOH).
Отсюда
M(1/z хлорида) = 2,918 × 40 / 1,8 = 64,8 (г/моль)
Пример 3
При сжигании 2,96 г металла было получено 4,91 г его оксида. Определить молярную массу эквивалента металла.
Решение
Найдем массу кислорода, израсходованного при горении металла. В соответствии с законом сохранения массы веществ
m(O2) = m(оксида) – m(металла) = 4,91 – 2,96 = 1,95 (г).
При окислении металлов до оксидов газообразным кислородом происходит процесс: О20 + 4е- = 2О–2. Молекула кислорода принимает 4 электрона, следовательно, z = 4. На один электрон приходится 1/4 О2, поэтому эквивалент молекулярного кислорода 1/4 O2, а молярная масса эквивалента равна 8 г/моль.
По закону эквивалентов m(O2) / m(Me) = M(1/4 O2) / M(1/z Me);
Отсюда выразим M(1/z Me) и подставим численные значения величин:
M(1/z Me) = 2,96 × 8 / 1,95 = 12,1 (г/моль)
Пример 4
Некоторый газ, имеющий плотность по воздуху, равную 0,965, был собран в сосуд емкостью 2 л методом вытеснения воды и находится в нем при температуре 25 оС и давлении 99,8 кПа. Определите массу газа в сосуде, если давление паров воды составляет 3,17 кПа.
Решение
Так как газ был собран в сосуд методом вытеснения воды, то он содержит пары воды. В соответствии с законом Дальтона для смеси не взаимодействующих газов, общее давление газовой смеси складывается из парциальных давлений отдельных ее компонентов. Найдем давление неизвестного газа.
Ргаза=Рсмеси–Рпара воды= 99,8 кПа– 3,17 кПа= 96,63 кПа.
Зная относительную плотность газа по воздуху, рассчитаем его молярную массу в соответствии со следствием из закона Авогадро.
Мгаза=Dвозд.×Мвозд= 0,965 × 29 г/моль» 28 г/моль.
Выразим массу газа m из уравнения Клапейрона-Менделеева и подставим в полученное выражение все величины в единицах системы СИ.
 ;
;
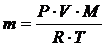

Итак, масса газа в сосуде равна 2,18 г.
Не нашли, что искали? Воспользуйтесь поиском: