
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электрический ток в растворах и расплавах электролитов
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы. Это процесс называется электролитической диссоциацией.
Степенью диссоциации называется доля молекул в растворенном веществе, распавшихся на ионы. Она зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Ионы разных знаков при встрече могут снова объединяться в нейтральны молекулы – рекомбинировать. При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за единицу времени на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы.
При включении сосуда с раствором электролита в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные – к отрицательному – катоду. В результате устанавливается электрический ток. Поскольку перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной.
Закон электролиза
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (окислительная реакция), а на катоде положительные ионы положительные ионы получают недостающие электроны (восстановительная реакция)
Процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, называется электролизом.
Фарадей установил, что при прохождении электрического тока через электролит масса вещества, выделившегося на электроде, пропорциональна заряду, прошедшему через электролит:  или
или
 ,
,
где I – сила тока, а  - время пропускания тока через электролит.
- время пропускания тока через электролит.
Это утверждение называется законом электролиза Фарадея.
Очевидно, что масса выделившегося вещества равна произведению массы одного иона 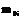 на число ионов
на число ионов  , достигших электрода за время
, достигших электрода за время  :
:
 (1)
(1)
Масса иона равна отношению массы одного моля вещества (молярной массы) к числу ионов в одном моле (числу Авогадро):
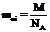 (2)
(2)
Число ионов, достигших электрода, равно
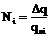 , (3)
, (3)
где  - заряд, протекший через электролит за время
- заряд, протекший через электролит за время  ,
,  - заряд иона, который определяется валентностью атома:
- заряд иона, который определяется валентностью атома:  (e – элементарный заряд).
(e – элементарный заряд).
Из выражений (1), (2) и (3) получим:

Таким образом, коэффициент пропорциональности k в законе Фарадея равен:

Он зависит от природы вещества (молярной массы М и валентности n) и численно равен массе вещества, выделившегося на электродах при переносе ионами заряда, равного 1 Кл. Величину k называют электрохимическим эквивалентом данного вещества и выражают в (кг/Кл).
Физический смысл электрохимического эквивалента: отношение массы иона к его заряду.
Не нашли, что искали? Воспользуйтесь поиском: