
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
7 страница. £P углекислый газ
£P углекислый газ
££ оксид азота (IV)
1343. Используя реакции гидролиза, какие из катионов Sb3+, Cr3+, Mn2+, Fe3+ можно разделить?
££ Sb3+, Cr3+от Mn2+, Fe3+
£P Sb3+от Cr3+, Mn2+, Fe3+
££ Fe3+от Sb3+, Cr3+, Mn2+,
££ Fe3+, Sb3+ от Cr3+, Mn2+,
££ Sb3+, Mn2+от Cr3+, Fe3+
1344. Используя явление амфотерности, какие из катионов Sb3+, Al3+, Mn2+, Zn2+, Fe3+ можно разделить?
££ Al3+, Fe3+от Mn2+, Zn2+, Sb3+
£P Al3+, Sb3+, Zn2+от Mn2+, Fe3+
££ Al3+, Zn2+от Sb3+, Fe3+, Mn2+,
££ Zn2+от Fe3+, Sb3+,Al3+, Mn2+,
££ Sb3+от Mn2+, Al3+, Fe3+, Zn2+
1345. Энтропия системы уменьшается при
££ нагревании
££ плавлении льда
££ расширении системы
£P другой ответ
1346. Какая из приведенных ниже реакций будет протекать самопроизвольно?
££ FeCl2+Sn  SnCl2+Fe
SnCl2+Fe
££ Cu(NO3)2+2Ag  2AgNO3+Cu
2AgNO3+Cu
£P 2FeCl3+SnCl2  2FeCl2+SnCl4
2FeCl2+SnCl4
££ ZnSO4+Cu  Zn+CuSO4
Zn+CuSO4
1347. Из водных растворов каких солей можно выделить электролизом металлы со 100%-ным выходом по току (среда слабокислая)?
££ Ca(NO3)2
£P AgNO3
££ Zn(NO3)2
££ Mn(NO3)2
1348. Наиболее сильные основные свойства проявляет
££ аммиак
££ анилин
£P диэтиламин
££ другой ответ
1349. Наиболее сильные кислотные свойства проявляет
££ вода
££ этанол
£P фенол
££ другой ответ
1350. Бензол не взаимодействует с
££ бромом в присутствии железа
£P водно-щелочным раствором перманганата калия
££ нитрующей смесью при нагревании
1351. С металлическим натрием взаимодействует
££ этилен
££ этан
£P метилацетилен
££ диметилацетилен
1352. Какая из приведенных реакций невозможна?
££ СН3СООН + СН3СН2ОН (Н+) 
££ Н2СО + СН3ОН (Н+) 
££ С6Н5СООН + СН3ОН (Н+) 
£P СН3СООН + С6Н5ОН (Н+) 
1353. В каком соединении наименее прочная химическая связь?
££ аммиак
££ фосфин
£P арсин
££ сероводород
1354. В результате какой из реакций можно получить сероводород?
££ FeS + HNO3 
£P FeS + HCl 
££ CuS + HCl 
££ Na2S + HNO3 
1355. В каком случае нельзя получить азотную кислоту?
££ Ba(NO3)2 + H2SO4 
££ NaNO3(тв) + H2SO4(конц) 
££ NO2 + H2O + О2 
£P NaNO3 + HCl(р-р) 
1356. Определите положение элемента в периодической системе Д.И. Менделеева, если валентная структура атома элемента 3s23p4
££ в 3-м периоде, в 4-й группе
£P в 3-м периоде, в 6-й группе
££ в 6-м периоде, в 4-й группе
££ другой ответ
1357. Из водных растворов какой соли невозможно восстановить металл электролизом?
££ AgNO3
£P Ca(NO3)2
££ CuCl2
££ PbCl2
1358. Какое вещество можно хранить в школьном химическом кабинете и использовать на уроках химии?
££ металлический калий
£P металлический кальций
££ ртуть и ее соединения
££ хромовый ангидрид
1359. Какой прибор можно использовать для демонстрации опыта получения хлора?
£P колбу Вюрца с газоотводной трубкой
££ аппарат Киппа
££ прибор Кирюшкина
££ другой ответ
1360. С каким соединением хлороводород будет взаимодействовать против правила Морковникова?
£P СН2СНСОН
££ СН2СНСН2СООН
££ СН3СНСН2
1361. Высшие жирные кислоты в процессе их диструктивного обмена разрушаются преимущественно путем
££ восстановления
££ декарбоксилирования
££  - окисления
- окисления
£P 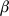 - окисления
- окисления
1362. Какая из реакций может быть использованая для получения галогеноводорода?
££ NaI(тв) + H2SO4(конц)
££ NaI(тв) + HNO3(конц)
£P другой ответ
1363. Какой из гидроксидов можно получить гидратацией соответствующего оксида?
££ Zn(OH)2
£P Ba(OH)2
££ H2SiO3
££ Fe(OH)3
1364. Добавление какого вещества приведет к разрушению аммиачного комплекса меди?
££ нитрата меди (II)
££ хлорида меди (II)
££ аммиака
£P сульфида натрия
1365. Одинаковое число молекул (при одинаковых условиях) содержится в
££ 1 г водорода и 1 г кислорода
£P 1 г водорода и 16 г кислорода
££ 1 г водорода и 8 г кислорода
1366. В какой реакции выделяется водород?
££ HNO3(конц) + Cu 
££ HNO3(разб) + Cа 
£P КОН(р-р) + Al 
££ HCl + Cu 
1367. В каком соединении ковалентность и степень окисления азота численно не совпадают?
££ аммиак
£P азотная кислота
££ хлорид азота (III)
££ другой ответ
1368. Умягчение воды заключается в удалении
££ всех катионов
££ всех солей
££ карбонатов кальция и магния
££ гидрокарбонатов кальция и магния
£P ионов кальция и магния
1369. Какие процессы протекают только при каталитическом крекинге (в отличие от термического крекинга)?
££ образование олефинов и ароматических углеводородов
££ полимеризация и конденсация углеводородов
£P изомеризация и перераспределение водорода
££ полимеризация и образование ароматических углеводородов
££ изомеризация и образование олефинов
1370. Согласуются ли данные опыта с законом постоянства состава:
££ в 1.10 г СO2, полученного при сгорании угля, содержится 0.20 г С
££ в 0.84 г СO2, полученного при разложении Н2СО3, содержится 0.50 г С
£P в 0.88 г СO2, полученного при прокаливании известняка, содержится 0.64 г O2
££ в 1.10 г СO2, полученного при сгорании С2Н4, содержится 0.35 г С
££ в 2.30 г СO2, полученного при разложении CuСО3, содержится 0.85 г O2
1371. Подтверждают ли данные опыта закон постоянства состава:
В | П
££ из 1.59 г CuО при восстановлении H2 образовалось 2.36 г H2O
££ из 2.33 г FeО при восстановлении H2 образовалось 0.11 г H2O
££ из 10 кг NaОН при взаимодействии с H2SO4 образовалось 3 кг H2О
£P из 1.99 г CuО, полученного при разложении малахита, образовалось при восстановлении водорода 0.45г H2O
££ из 4 л H2 при взаимодействии с О2 образовалось 0.5 л H2О
1372. Подъемная сила (разность весов 1 м3 воздуха и 1 м3 данного газа) водорода и гелия при нормальных условиях равна:
££ 1.5 кг/м3 и 1.5 кг/м3
£P 1.2 кг/м3 и 1.1 кг/м3
££ 10 кг/м3 и 15 кг/м3
££ 3.4 кг/м3 и 3.0 кг/м3
££ 2.9 кг/м3 и 2.5 кг/м3
1373. Во сколько раз легче (тяжелее) воздуха: водяной пар, сероводород, гелий:
££ 1.12, 0.16, 2.34
££ 3.04, 1.17, 1.86
££ 1.94, 0.25, 1.16
£P 0.62, 1.17, 0.135
££ 0.17, 2.15, 0.111
1374. Определите постоянную распада урана, если 1 г урана испускает в секунду 1.25x104  - частиц:
- частиц:
££ 2.2 x 10-5
££ 6.08 x 10-23
££ 3.7 x 10-9
££ 1.25 x 10-11
£P 5 x 10-18
1375. Определите постоянную распада радия, если 1 г радия испускает в секунду 3.7x1010  - частиц
- частиц
£P 1.37 x 10-11
££ 4.3 x 10-9
££ 5.8 x 10-13
££ 0.55 x 10-7
££ 3.4 x 10-15
1376. При растворении кристаллогидрата CaCl2x6H2O массой 219 г в 1000 г воды образовался раствор хлорида кальция с массовой долей:
£P 9.1 %
££ 17.9 %
££ 21.9 %
££ 12.3 %
££ 8.7 %
1377. Сколько граммов хлорида аммония NН4Cl содержится в 405 г насыщенного при 150С раствора, если коэффициент растворимости этой соли при той же температуре равен 35 г:
££ 100 г
£P 105 г
££ 155 г
££ 56 г
££ 94.3 г
1378. В 50 г насыщенного при 400С раствора содержится 6.5 г К2SO4. Определите процентную концентрацию раствора и коэффициент растворимости:
££ 10 %, 5.6 г
££ 21 %, 44.1 г
£P 13 %, 14.9 г
££ 5.2 %, 7.8 г
££ 7.6 %, 10.5 г
1379. Растворимость КNО3 при 600С равна 110 г, а при 00С – 15 г. Сколько соли выпадет в осадок если 840 г насыщенного при 600С раствора охладить до 00С:
££ 415 г
££ 610 г
££ 260 г
£P 380 г
££ 590 г
1380. Имеется 3 кг 10%-ного раствора Na2SO4. Сколько граммов кристаллогидрата Na2SO4x10Н2О выпадет при медленном испарении всего раствора:
££ 778.1 г
£P 680.3 г
££ 520.4 г
££ 815.2 г
££ 422.7 г
1381. Сколько мл 96% серной кислоты (пл. 1.84 г/см3) нужно взять для приготовления 500 мл 0.05 М раствора:
££ 5 мл
££ 3.17 мл
££ 0.54 мл
££ 2.26 мл
£P 1.38 мл
1382. Вычислите рН раствора, если к 3 л воды прибавили 2 мл 96% серной кислоты (пл. 1.84 г/см3):
££ 2.71
£P 1.62
££ 3.12
££ 4.54
££ 2.11
1383. К 1 л 10%-ного раствора КОН (пл. 1.092 г/см3) прибавили 0.5 г 5%-ного раствора КОН (пл. 1.045 г/см3). Объем смеси довели до 2 л. Определите молярную концентрацию полученного раствора:
££ 3.5 М
££ 1.7 М
£P 1.2 М
££ 2.3 М
££ 4.1 М
1384. При электролизе раствора хлорида меди с платиновыми электродами на катоде выделилось 6.4 г меди. Объем выделившегося на аноде газа (н.у.) составил:
££ 4.48 л
£P 2.24 л
££ 1.12 л
££ 5.6 л
££ 11.2 л
1385. При электролизе раствора сульфата калия с угольными электродами на аноде выделилось 2.24 л газа (н.у.). Объем выделившегося на катоде газа составил при этом:
£P 4.48 л
££ 2.24 л
££ 1.12 л
££ 5.6 л
££ 11.2 л
1386. При рафинировании меди ток силой 50 А выделяет за 10 ч 550 г меди. Определите выход меди по току:
££ 70.64 %
££ 64.3 %
££ 87.1 %
£P 92.15 %
££ 98.88 %
1387. В растворе находилось 0.1 моля HgCl2 и 0.2 моля CuCl2. Какие вещества и в каком количестве выделятся на угольных электродах, если через раствор пропускать ток силой 10 А в течение 1 ч:
££ 14.36 г HClO, 15.89 г H2
££ 10.68 г O2, 4.11 г H2, 11.17 г HCl
££ 12 г O2, 3.22 г Hg, 20.5 г Cu
££ 4.5 г Hg, 8.6 г Cu(OH)2, 17.62 г HCl
£P 20.1 г Hg, 5.54 г Cu, 13.24 г Cl
1388. Электролиз раствора сульфата калия проводили при силе тока 5 А в течение 3 ч. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде:
££ 3.995 г, 7.5 л, 22.4 л
££ 7.67 г, 5.56 л, 11.222 л
££ 6.171 г, 4.333 л, 4.132 л
£P 5.03 г, 6.266 л, 3.133 л
££ 4.1 г, 5.22 л, 2.13 л
1389. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде:
£P 32.20 г, 1.67 л
££ 48.12 г, 5.6 л
££ 21.44 г, 11.2 л
££ 15.55 г, 5.14 л
££ 36.17 г, 3.78 л
1390. Сколько литров (н.у.) газа выделилось на катоде при электролизе раствора гидроксида калия, если в течение 1 ч 15 мин 20 с на аноде выделилось 6.4 г газа:
£P 8.96 л
££ 9 л
££ 7.64 л
££ 5.48 л
££ 10.53
1391. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5.4 г. Определите расход электричества при этом:
££» 5690 Кл
££» 2845 Кл
£P» 4830 Кл
££» 3650 Кл
££» 5240 Кл
1392. После озонирования некоторого объема кислорода наблюдалось уменьшение объема на 5 мл. Сколько мл озона образовалось и сколько мл кислорода на это израсходовано:
££ 10 и 10
£P 10 и 15
££ 15 и 10
££ 25 и 10
££ 5 и 10
1393. Сульфат двухвалентного металла массой 7.2 г образовал с избытком раствора хлорида бария осадок массой 13.98 г. Этот металл:
££ Zn
£P Mg
££ Cu
££ Fe
££ Ca
1394. Для хлорирования смеси порошков меди и железа массой 3.0 г потребовался хлор объемом 1.4 л (н.у.). Массовая доля меди в исходной смеси равна:
££ 46.6 %
££ 50.0 %
£P 53.3 %
££ 0.556 %
££ 0.445 %
1395. При полном растворении в воде смеси гидрида и фосфида щелочного металла с равными массовыми долями образовалось газовая смесь с плотностью по углекислому газу 0.2. Исходные соединения:
££NaH, Na3P
£PKH, K3P
££ RbH, Rb3P
££ CsH, Cs3P
££ FrH, Fr3P
1396. При каталитическом окислении 7.84 л (н.у.) аммиака получили 200 г раствора азотной кислоты с выходом кислоты, равным 40%. Процентная концентрация кислоты в полученном растворе равна:
££ 5.51 %
££ 11.03 %
£P 4.41 %
££ 8.82 %
££ 2.65 %
1397. Если неизвестный металл массой 13 г обработали разбавленным раствором HNO3, затем прибавили избыток щелочи, прокипятили, и при этом выделилось 1.12 л газа (н.у.), то этот неизвестный металл:
££ медь
£P цинк
££ железо
££ хром
££ марганец
1398. 4 г смеси карбонатов натрия и калия обработали серной кислотой. При этом получили 5.12 г смеси сульфатов металлов. Определите массовые доли веществ в исходной смеси:
££ 35% Na2CO3; 65% K2CO3
£P 25% Na2CO3; 75% K2CO3
££ 75% Na2CO3; 25% K2CO3
££ 20% Na2CO3; 80% K2CO3
££ 30% Na2CO3; 70% K2CO3
1399. Определите, сколько граммов 10 %-го раствора оксида серы (V1) в чистой серной кислоте и 60 %-го раствора серной кислоты необходимо для приготовления 480 г 90 %-го раствора кислоты:
££ 298.55; 181.45
£P 340.8; 139.2
££ 385.2; 94.8
1400. При обжиге навески пирита ее масса уменьшилась на 20 %. Определите состав (в массовых долях) образовавшейся смеси твердых веществ:
££ 40% сульфида железа; 60% оксида железа
£P 50% дисульфида железа; 50% оксида железа (111)
££ 60% бисульфата железа; 40% оксида железа (11)
1401. При прокаливании 80 г безводного сульфата трехвалентного элемента получается его оксид массой на 24 г меньше молярной массы элемента. Определите, какой это элемент:
££ Cr
£P Fe
££ Mn
1402. Приготовили 10 г смеси оксидов кальция и натрия, причем масса оксида кальция в смеси больше массы оксида натрия, но масса натрия больше массы кальция. Найти массу оксида кальция в смеси.
££ 4,0 – 4,1 г
££ 4,9 – 5,0 г
£P 5,0 – 5,1 г
££ 5,5 – 5,6 г
1403. После прокаливания 5,0 г смеси карбонатов магния, кальция, стронция и бария получили 2,4 г смеси оксидов этих металлов. Определить возможное значение массы карбоната магния в смеси.
££ 4,0 – 4,1 г
££ 4,2 – 4,3 г
££ 4,5 – 4,6 г
££ 4,7 – 4,8 г
£P 4,8 – 4,9 г
Не нашли, что искали? Воспользуйтесь поиском: