Равновесие в процессах абсорбции.
Требования к абсорбенту.
1) селективность;
2) нелетучесть;
3) дешевизна;
4) нетоксичность;
5) огневзрывобезопасность.
Применение процесса абсорбции.
а) получение целевых продуктов (абсорбция HCL водой в производстве соляной кислоты)
б) выделение ценных компонентов газовых смесей (ацетилена из газов крекинга метана);
в) удаление вредных примесей из газовых смесей (CO, CO2 из азотоводородной смеси при синтезе аммиака).
Физическая абсорбция. Хемосорбция.
Поглощение газа за счет его растворения в абсорбенте – ф. а.
Поглощение газа в результате его химического взаимодействия с абсорбентом. – х.а.
Равновесие в процессах абсорбции.
Равновесие может быть представлено в форме закона Генри  – закона растворимости газа в жидкости (уравнение прямой в прямоугольных координатах – закона растворимости газа в жидкости (уравнение прямой в прямоугольных координатах   - тангенс угла наклона), где - тангенс угла наклона), где  – коэффициент распределения, есть отношение Е (константы Генри) к Р (общего давления газовой фазы), а – коэффициент распределения, есть отношение Е (константы Генри) к Р (общего давления газовой фазы), а 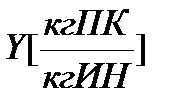 и и 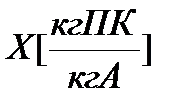 - равновесные концентрации;или в форме криволинейной зависимости в прямоугольных координатах, если - равновесные концентрации;или в форме криволинейной зависимости в прямоугольных координатах, если  – переменная величина (зависит от уровня концентраций (см. рис.). Закон Генри «работает» в углу диаграммы фазового равновесия (область малых концентраций поглощаемого компонента (ПК). – переменная величина (зависит от уровня концентраций (см. рис.). Закон Генри «работает» в углу диаграммы фазового равновесия (область малых концентраций поглощаемого компонента (ПК).
| Рис. Диаграмма фазового равновесия газ – жидкость.
|

Влияние температуры и давления на равновесие при абсорбции.
В соответствии с принципом Ле - Шателье при возрастании температуры уменьшается концентрация ПК в жидкой фазе (см. рис.). При возрастании давления, напротив, увеличивается концентрация ПК в жидкой фазе (см. рис.).
| Рис. Диаграмма фазового равновесия газ – жидкость. Влияние давления на состояние равновесия систем газ – жидкость.
| | Рис. Диаграмма фазового равновесия газ – жидкость. Влияние температуры на состояние равновесия систем газ – жидкость.
|

Проведение процесса абсорбции осуществляют при повышенном давлении и пониженной температуре. Реализация процесса десорбции осуществляется при пониженном давлении и повышенной температуре системы.
Процесс абсорбции отличает избирательность и обратимость.
Рис.1. Схема сочетания процессов абсорбции и десорбции: 1 – абсорбер; 2 – десорбер; 3 – теплообменник; 4 – холодильник; 5 – подогреватель; насос; 6 – дроссельный вентиль; «ИН+ПК» - исходная газовая смесь (инерт и + поглощаемый компонент); «А+ПК» - абсорбент + поглощаемый компонент; Q – подвод теплоты.
Способы проведения процесса абсорбции.
Прямоток (см. раздел «Некоторые общие вопросы процессов массообмена»), противоток (см. там же), противоток с рециркуляцией абсорбента.
Абсорбция с рециркуляцией абсорбента.
К такому способу абсорбции прибегают тогда, когда: стоимость абсорбента велика, и желательно сократить расход свежего абсорбента (в задачах проектирования); требуется увеличить плотность орошения насадки при сохранении расхода свежего абсорбента (в задачах эксплуатации).
Схема работы абсорбера с рециркуляцией абсорбента показана на рисунке.
Рис. Схема работы абсорбера с рециркуляцией абсорбента и диаграмма y-x: 1 – рабочая линия абсорбции с рециркуляцией; 2 – рабочая линия абсорбции без рециркуляции (n = 0); 3 – рабочая линия абсорбции с рециркуляцией (с предельно максимальным значением коэффициента рециркуляции, когда число теоретических тарелок  ). ).
|
Коэффициент рециркуляции показывает: какая масса отработанного абсорбента возвращается на единицу массы свежего абсорбента, т.е. размерность этой величины есть кг А отраб./кг А свежего.
Для установления связи между составами жидкой фазы на входе в абсорбер составляют уравнение материального баланса для контура К1 по ПК
 , откуда, при известных значениях , откуда, при известных значениях 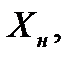  и и 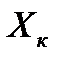 , можно определить состав смеси , можно определить состав смеси
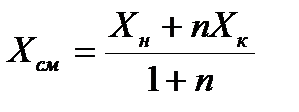 . (2.1) . (2.1)
Для вывода уравнения рабочей линии процесса абсорбции с рециркуляцией абсорбента составляют уравнение материального баланса для контура К2 по ПК
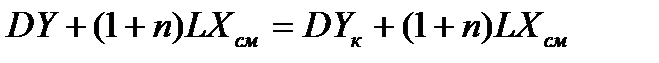 ; откуда ; откуда
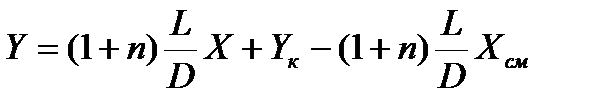 . (1.1) . (1.1)
Уравнение (1.1) – уравнение рабочей линии процесса абсорбции с рециркуляцией абсорбента.
При n = 0 уравнение (1.1) с учетом уравнения (2.1) трансформируется в уравнение р.л. для противоточного процесса абсорбции без рециркуляции
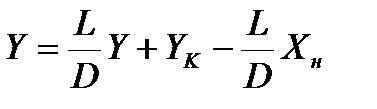 . .
Коэффициент рециркуляции имеет следующие предельные значения:  - для абсорбции без рециркуляции (на рисунке – р.л. 2); - для абсорбции без рециркуляции (на рисунке – р.л. 2);  - при предельном положении рабочей линии процесса абсорбции с рециркуляцией (на рисунке – р.л. 3), когда - при предельном положении рабочей линии процесса абсорбции с рециркуляцией (на рисунке – р.л. 3), когда  . Действительная рабочая линия построена для . Действительная рабочая линия построена для 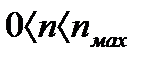 и проходит через точки А( и проходит через точки А(  ) и С( ) и С( 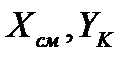 ). ).
Зная положение действительной рабочей линии, определяют число теоретических тарелок или число единиц переноса массы и далее по «списку». Заметим, что минимальное число теоретических тарелок получают при 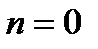 , максимальное – при , максимальное – при 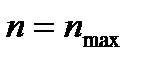 . .
Движущая сила процесса абсорбции при рециркуляции абсорбента уступает движущей силе процесса абсорбции без рециркуляции абсорбента. Однако увеличение плотности орошения насадки ведет: к увеличению турбулентности жидкой пленки, следовательно, к уменьшению толщины жидкой пленки, следовательно, к увеличению коэффициента массоотдачи по жидкой фазе, следовательно, к возрастанию коэффициента массопередачи. Увеличение плотности орошения ведет к возрастанию смачиваемости насадки, следовательно, к возрастанию поверхности контакта фаз. Конечным результатом этих явлений может быть полная или частичная компенсация явления понижения концентрационного напора.
Не нашли, что искали? Воспользуйтесь поиском:
|

 – закона растворимости газа в жидкости (уравнение прямой в прямоугольных координатах
– закона растворимости газа в жидкости (уравнение прямой в прямоугольных координатах 
 - тангенс угла наклона), где
- тангенс угла наклона), где  – коэффициент распределения, есть отношение Е (константы Генри) к Р (общего давления газовой фазы), а
– коэффициент распределения, есть отношение Е (константы Генри) к Р (общего давления газовой фазы), а 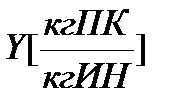 и
и 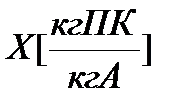 - равновесные концентрации;или в форме криволинейной зависимости в прямоугольных координатах, если
- равновесные концентрации;или в форме криволинейной зависимости в прямоугольных координатах, если  – переменная величина (зависит от уровня концентраций (см. рис.). Закон Генри «работает» в углу диаграммы фазового равновесия (область малых концентраций поглощаемого компонента (ПК).
– переменная величина (зависит от уровня концентраций (см. рис.). Закон Генри «работает» в углу диаграммы фазового равновесия (область малых концентраций поглощаемого компонента (ПК). 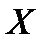
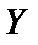


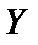
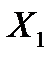
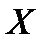


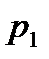
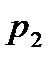
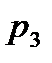
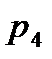
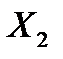
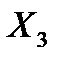

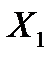
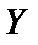
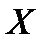


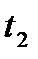

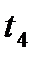
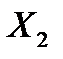
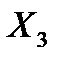



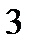
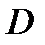
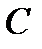
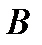
 ).
).


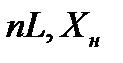
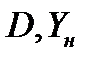

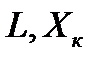

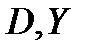
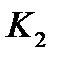
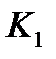
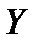
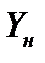
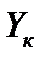
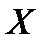

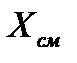
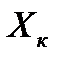
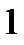
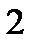
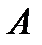
 , откуда, при известных значениях
, откуда, при известных значениях 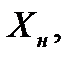
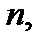 и
и 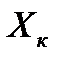 , можно определить состав смеси
, можно определить состав смеси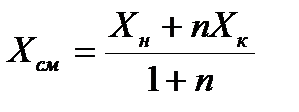 . (2.1)
. (2.1)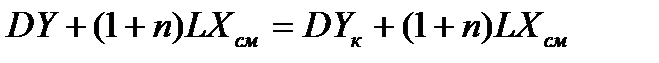 ; откуда
; откуда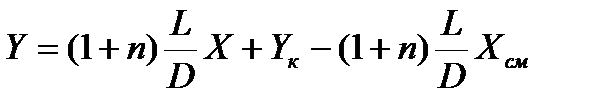 . (1.1)
. (1.1)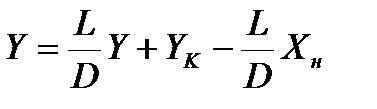 .
. - для абсорбции без рециркуляции (на рисунке – р.л. 2);
- для абсорбции без рециркуляции (на рисунке – р.л. 2);  - при предельном положении рабочей линии процесса абсорбции с рециркуляцией (на рисунке – р.л. 3), когда
- при предельном положении рабочей линии процесса абсорбции с рециркуляцией (на рисунке – р.л. 3), когда  . Действительная рабочая линия построена для
. Действительная рабочая линия построена для 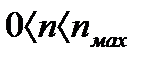 и проходит через точки А(
и проходит через точки А(  ) и С(
) и С( 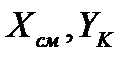 ).
).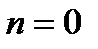 , максимальное – при
, максимальное – при 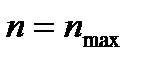 .
.