
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Спирт — растворитель. 2 страница

В демонстрационной пробирке (цилиндре, химическом стакане) получают гидроксид меди, добавляя к 4-5 мл раствора медного купороса раствор щелочи до полного осаждения гидроксида. Для успеха опыта щелочь должна быть непременно в избытке, поэтому, ставя опыт, учитель должен соотнести концентрации имеющихся растворов.
Осадок взбалтывают и половину его переносят в другую пробирку. К одной порции добавляют глицерин, пока при взбалтывании осадок гидроксида не исчезнет и Fie образуется темно-синий раствор. Сравнивают окраску раствора с окраской осадка гидроксида в другой пробирке.
Реакция с гидроксидом меди считается качественной реакцией на многоатомные спирты.
ФЕНОЛ
В данном разделе наиболее существенными являются опыты, показывающие растворимость фенола в щелочи, дезинфицирующее действие его и характер взаимного влияния атомов в молекуле фенола.
Растворимость фенола в воде и щелочах. В пробирку с несколькими кристалликами фенола приливают 2-3 мл воды. Пробирку закрывают пробкой и встряхивают. Убеждаются, что фенол не полностью растворился в воде и образовал непрозрачную эмульсию. Дают эмульсии отстояться, жидкость расслаивается: внизу образуется раствор воды в феноле, вверху — раствор фенола в воде.
Содержимое пробирки снова взбалтывают и к эмульсии фено-
ла прибавляют по каплям раствор щелочи. Раствор становится прозрачным, так как образующийся фенолят растворим в воде:
С6Н5ОН + NaOH à С6Н5ОNa + Н2О
В этой реакции фенол проявляет кислотные свойства. Это подтверждается и тем, что при действии кислот (добавляют по каплям соляную кислоту) фенол снова выделяется из раствора:
C6H5ONa + HCI à C6H5ONa + NaCl
Фенол — слабая кислота. Для приблизительного определения силы кислоты достаточно установить, какими кислотами она может вытесняться из солей. Фенол слабее угольной кислоты, поэтому при действии угольной кислоты на фенолят натрия образуется фенол:
С6Н5ОNa + (H2CO3) à С6Н5ОН + NaHCO3
Раствор фенолята натрия получают, прибавляя раствор щелочи к эмульсии фенола (избегать избытка щелочи!). Далее в него пропускают углекислый газ из аппарата Киппа. Образуется муть вследствие выделения свободного фенола.
Реакция фенола с бромной водой. Опыты, на которых можно развить идею о взаимном влиянии атомов в молекулах, имеют большое воспитательное значение. Взаимное влияние атомов можно рассмотреть на примере фенола после ознакомления с его кислотными свойствами.
Большая в сравнении со спиртами подвижность гидроксильного атома водорода в молекуле фенола (реакция со щелочью) обусловлена влиянием на гидроксильную группу соединенного с ней бензольного кольца. Гидроксильная группа в свою очередь влияет на бензольное ядро, ослабляя в орто- и пара-положениях связи атомов водорода с атомами углерода, вследствие чего атомы водорода значительно легче, чем в бензоле, замещаются атомами брома. Бензол, как известно, не реагирует с бромной водой (реагирует с чистым бромом в присутствии железа), фенол же легко реагирует с бромной водой, сразу замещая на бром три атома водорода в своей молекуле.
В демонстрационную пробирку берут немного (на кончике ножа) фенола и добавляют воды столько, чтобы при взбалтывании получился раствор (а не эмульсия) фенола. Далее прибавляют насыщенную бромную воду. Сначала образуется белая муть, а затем осадок трибромфенола:
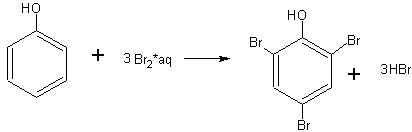
Трибромфенол обладает устойчивым неприятным запахом, поэтому надо остерегаться попадания его на руки и одежду.
Качественная реакция фенола. Характерной качественной реакцией на фенолы является взаимодействие с хлоридом железа(III). К разбавленному раствору (не эмульсии!) фенола добавляют несколько капель раствора хлорида железа FeCI3, Жидкость окрашивается в темно-фиолетовый цвет (белый экран!).
Дезинфицирующее действие фенола. Дезинфицирующее действие фенола основано на том, что он свертывает белок, чем прекращает жизнедеятельность бактерий.
Это действие наблюдают, прибавляя к небольшому количеству раствора куриного яйца в пробирке расплавленный фенол и взбалтывая смесь.
Следует указать учащимся, что этим же свойством фенола обусловливается появление белых пятен на коже рук при неосторожном обращении с ним.
Нитрование фенола. При нитровании фенола образуется тринитрофенол — пикриновая кислота:

К 3 мл концентрированной азотной кислоты в пробирке приливают 1 мл (не больше) воды и в разбавленную, таким образом кислоту вносят по каплям 0,5 мл расплавленного фенола. Полученную смесь взбалтывают и нагревают до кипения. При последующем охлаждении образуются красивые желтые кристаллы пикриновой кислоты.
Получение фенола из салициловой кислоты. Способы получения фенола не рассматриваются в школьном курсе химии. На внеклассных занятиях (лучше после изучения кислот) можно поставить опыт получения фенола из салициловой кислоты. Существует большая аналогия между получением метана, бензола и фенола при
взаимодействии соответствующих кислот или их солей со щелочью. Везде происходит образование карбоната и соответствующего углеводорода или его производного:
CH3COONa + NaOH à CH4 + Na2CO3
C6H5COONa + NaOH à C6H6 + Na2CO3

Для получения фенола можно воспользоваться салицилатом натрия или непосредственно салициловой кислотой. Эти вещества могут быть приобретены в аптеке.
В пробирку с отводной трубкой помещают смесь примерно одинаковых объемов салициловой кислоты, гидроксида натрия и оксида кальция. Смесь нагревают, опустив отводную трубку в известковую воду. Убеждаются в выделении углекислого газа. Затем отводную трубку опускают в сухую пробирку и отгоняют столько фенола, сколько позволяет исходное количество салициловой кислоты. Убеждаются в получении фенола по запаху и по реакции с раствором хлорида железа. Применять холодильник приэтом, разумеется, нет необходимости.
ПРОСТЫЕ ЭФИРЫ
Простые эфиры рассматриваются на уроках химии в общих чертах. Можно экспериментально ознакомить учащихся лишь с важнейшим представителем этого класса соединений — диэтиловым (серным) эфиром. Наибольшее значение здесь будут иметь опыты, иллюстрирующие некоторые физические свойства эфира и получение его из этанола. Лабораторные опыты с эфиром ставить не следует, так как пары его огнеопасны.
Низкая температура кипения эфира. Эфир является одной из жидкостей, обладающих низкой температурой кипения.
Нагревают в химическом стакане воду примерно до 50'С. В нагретую воду вносят пробирку с эфиром — эфир закипает. Одновременно можно внести пробирки с другими известными учащимся жидкостями (бензол, этанол) — кипение жидкостей не наступает.
Охлаждение при испарении эфира. Имея низкую температуру кипения, эфир оказывается чрезвычайно летучей жидкостью. На испарение его затрачивается много теплоты, вследствие чего происходит охлаждение окружающей среды. Испарение (и, следова-
тельно, охлаждение) может быть усилено при продувании воздуха через эфир.
а) На легкую деревянную пластинку ставят смоченный снизу водой тигелек, наливают 8 него 1 мл эфира и продувают через эфир воздух грушей. Тигелек примерзает к пластинке.
б) В пробирку (рис. 26) наливают 1—2 мл воды и помещают ее в стаканчик, где налит слой эфира в 1 см. Грушей продувают через эфир воздух. Вода в пробирке вскоре замерзает.
в) Продувают воздух через эфир, находящийся в пробирке, погруженной в воду. Вскоре пробирка снаружи покрывается ледяной корочкой.
Пары эфира тяжелее воздуха. По молекулярному весу эфира учащиеся находят, что пары эфира более чем в 2,5 раза тяжелее воздуха. Это свойство эфира, одновременно с его горючестью, может быть продемонстрировано рядом опытов.
а) К концу воронки без крана присоединяют загнутую вверх трубочку с оттянутым концом (рис. 27). В воронку кладут комочек ваты, смоченной эфиром. Через 2—3 сек поджигают пары эфира у отверстия трубки.

б) В стеклянную банку вводят несколько капель эфира и затем пускают туда табачный дым. Пары эфира, окрашенные дымом, можно переливать, как жидкость, из сосуда в сосуд и даже налить на поверхность стола, где они будут стелиться тяжелым облаком.
Взаимная растворимость эфира и воды. В демонстрационной пробирке к 10 мл воды добавляют понемногу эфир. При взбалтывании первые порции эфира частично растворяются в воде, затем на
поверхности собирается избыток эфира. Добавляют его еще немного, смесь взбалтывают и дают отстояться. Жидкость разделяется на два слоя: нижний слой — раствор эфира в воде, верхний слой — раствор воды в эфире.
Разделяют растворы с помощью делительной воронки и доказывают наличие воды в эфире и эфира в воде. Бросают в эфирный слой порошок безводного сульфата меди, наблюдают образование медного купороса. Нагревают в пробирке водный слой и поджигают выделяющиеся пары; наблюдают горение эфира.
Эфир как растворитель. Эфир — хороший растворитель многих веществ, в частности жиров. Применение его в качестве растворителя ограничивается лишь его огнеопасностью. Опыты по растворению веществ эфиром могут быть поставлены аналогично опытам с другими растворителями. Учащимся предлагается самостоятельно удалить при помощи эфира жирное пятно с ткани.
Получение эфира из спирта. Получение диэтилового эфира интересно тем, что очень убедительно показывает учащимся влияние условий реакции на образование разных продуктов из одних и тех же исходных веществ. Этиловый спирт и концентрированная серная кислота при нагревании выше 140— 150°С дают преимущественно этилен (с. 46), при температуре ниже 140°С дают диэтиловый эфир.
На результат реакции оказывают влияние и относительные количества взятых веществ.
При получении эфира относительное количество спирта должно быть больше, чем при получении этилена. Это объясняется тем, что эфир образуется при действии на этилсерную кислоту дополнительного количества спирта:
C2H5OSO2OH + НОС2Н5 à С2Н5— О — С2Н5 + H2SO4,
тогда как этилен получается при разложении этилсерной кислоты:
C2H5OSO2OH à С2Н4 + H2SO4.
Учащимся это может быть разъяснено так: при образовании молекулы этилена серная кислота отнимает воду от каждой молекулы спирта, а при образовании эфира она отнимает воду от каждых двух молекул спирта:

Опыт ведут так, чтобы вначале получить этилсерную кислоту, а затем к ней добавляют спирт и отгоняют эфир, нагревая жидкость не выше 140°С.
В небольшую колбу (рис. 28) наливают равные по объему ко-
личества спирта (ректификата) и концентрированной серной кислоты, что соответствует примерно эквимолекулярным соотношениям. В воронку наливают дополнительное количество спирта. В качестве приемника используют колбу Бунзена, которую ставят в сосуд со льдом и к боковой трубке его присоединяют длинную каучуковую трубку для отвода несконденсировавшихся паров эфира (под тягу или за окно).
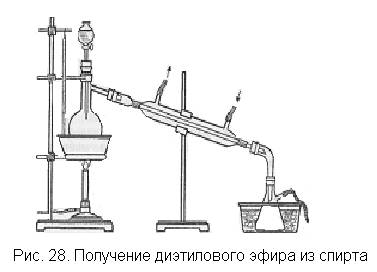
Нагревают колбу на песчаной бане (песок должен быть нагрет заранее) до температуры 140'С и, когда начнет перегоняться эфир, добавляют понемногу из воронки этанол. Через холодильник должна идти сильная струя холодной воды. Опыт ведут до получения необходимого для демонстрации количества эфира. С эфиром неизбежно отгоняется некоторое количество спирта и воды. Чтобы эфир отмыть от спирта, дистиллят переносят в делительную воронку, добавляют к нему равный объем воды, содержимое воронки взбалтывают, дают жидкости отстояться, сливают нижний водный слой, а эфир переносят в пробирку и демонстрируют классу.
После удаления спирта эфир промывают слабым раствором щелочи, освобождаясь от кислот, затем снова промывают водой и сушат хлоридом кальция. Эти операции выполняют уже не на уроке.
Проверка чистоты эфира. Большое значение имеет ознакомление учащихся, хотя бы в процессе кружковой работы, с методами проверки чистоты реактивов. Наиболее просто это можно осуществить с диэтиловым эфиром. Как видно из способа получения, недостаточно чистый эфир может содержать воду, кислоту, спирт.
Чтобы убедиться, содержит ли эфир воду, кислоту или спирт, в пробу его бросают маленький кусочек очищенного натрия. При наличии воды выделяется водород.
Наличие кислоты можно установить, если к пробе эфира добавить небольшое количество воды, жидкости взболтать, спустить из делительной воронки нижний водный слой и испытать его лакмусовой бумажкой.
Для открытия спирта проводят иодоформную реакцию. К пробе эфира добавляют немного воды, 2—3 капли раствора йода в иодиде калия или кристаллики йода и хорошо взбалтывают смесь. Затем обесцвечивают раствор незначительным количеством щелочи и подогревают. При наличии спирта после охлаждения образуется запах, а затем появляются желтые кристаллики йодоформа.
Сравнение свойств диэтилового эфира и бутанола. При изучении спиртов и простых эфиров впервые появляется возможность ознакомиться практически со свойствами изомерных веществ и убедиться, что при одинаковом составе между ними могут быть существенные различия. Наиболее доступным для опытов примером будет изомерия диэтилового эфира и бутанола (или изобутанола), так как оба эти вещества представляют собой жидкости и довольно распространены в лабораториях.
а) В одну пробирку наливают сухого диэтилового эфира, в другую пробирку — примерно столько же бутанола и помещают в жидкости по кусочку натрия. Замечают, что натрий с эфиром не взаимодействует, со спиртом же реакция идет, и выделяется водород.
б) В две пробирки наливают по одинаковому количеству диэтилового эфира и бутанола (например, по 1 мл). Помещают пробирки в заранее подготовленный стакан с горячей водой (50-60°С). Эфир при таком нагревании закипает, и пары его могут быть подожжены; спирт не кипит и не образует горючих паров.
ГЛАВА VI
АЛЬДЕГИДЫ И КЕТОНЫ
При изучении альдегидов учащиеся на опытах знакомятся со ступенчатым характером окисления органических веществ, с химизмом важных производственных процессов и с принципом получения синтетических смол.
Чтобы место альдегидов в ряду продуктов окисления углеводородов было понятно учащимся, при составлении химических уравнений не следует избегать пользования названиями и формулами кислот, в которые альдегиды превращаются. Формулы кислот могут быть даны предварительно догматически; в дальнейшем учащиеся получат для них экспериментальное обоснование.
При изучении альдегидов больше всего опытов ставится с формальдегидом как веществом, наиболее доступным для школы и имеющим большое промышленное значение. В соответствии с этим в настоящей главе формальдегиду отведено основное место. Для уксусного альдегида рассматриваются лишь реакции получения. Кетоны специально не изучаются в школе; поэтому из них здесь взят лишь один представитель — ацетон, и опыты с ним даны преимущественно для внеклассной работы учащихся.
ФОРМАЛЬДЕГИД (МЕТАНАЛЬ)
План изучения этого вещества целесообразно построить так, чтобы сразу после ознакомления с физическими свойствами альдегидов учащиеся изучили способы получения его, затем химические свойства и т.д. Несколько более раннее ознакомление со способами получения альдегида даст возможность далее, при изучении химических свойств (реакции окисления), рассматривать альдегиды как звено в цепи окисления углеводородов.
В качестве образца при ознакомлении со свойствами формальдегида можно пользоваться формалином. При этом следует сразу же добиться, чтобы учащиеся отчетливо понимали разницу между формалином и формальдегидом.
Запах формальдегида. Из физических свойств формальдегида наиболее доступно на практике ознакомление с запахом. Для этой цели на ученические столы раздаются пробирки с 0,5-1 мл формалина. После того как учащиеся ознакомятся с запахом, формалин может быть собран и использован для дальнейших опытов. Ознакомление с запахом формалина даст возможность учащимся обнаруживать это вещество в других опытах.
Горючесть формальдегида. Нагревают формалин в пробирке и поджигают выделяющиеся пары; они горят почти бесцветным пламенем. Пламя можно заметить, если в нем поджечь лучинку или бумажку. Опыт проводят в вытяжном шкафу.
Получение формальдегида. Так как до ознакомления с химическими свойствами формальдегид может быть обнаружен только по запаху, то первый опыт получения его следует поставить в виде лабораторной работы.
1. В пробирку наливают несколько капель метанола. В пламени горелки нагревают свернутый в трубочку небольшой кусочек медной сетки или спираль из медной проволоки и быстро опускают ее в метанол.
При прокаливании медь окисляется и покрывается черным налетом оксида меди, в спирте она снова восстанавливается и становится красной:

Обнаруживают резкий запах альдегида. Если процесс окисления повторить 2—3 раза, то можно получить значительную концентрацию формальдегида и раствор использовать для последующих опытов.
2. Кроме оксида меди для получения формальдегида могут быть использованы другие знакомые учащимся окислители.
К слабому раствору перманганата калия в демонстрационной пробирке добавляют 0,5 мл метанола и смесь нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.

В пробирку наливают 2—3 мл насыщенного раствора бихромата калия К2Сг2О7 и такой же объем концентрированной серной кислоты. Добавляют по каплям метанол и очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Далее реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома

Уравнение реакции с учащимися можно не разбирать. Как и в предыдущем случае, им лишь сообщается, что бихромат калия окисляет метиловый спирт в альдегид, превращаясь при этом в соль трехвалентного хрома Cr2(SO4)3.
Взаимодействие формальдегида с оксидом серебра (реакция серебряного зеркала). Этот опыт должен быть продемонстрирован учащимся так, чтобы он одновременно явился и инструктажем к последующему практическому занятию.
Природа аммиачного раствора оксида серебра может быть подробно разъяснена учащимся, а можно лишь сообщить им, что образующийся при реакции гидроксид серебра — вещество непрочное и легко распадается на оксид серебра и воду:
AgNO3 + NH4OH à AgOH + NH4NO3
2AgOH à Ag2O + H2O
Оксид серебра обладает свойством растворяться в аммиаке.
Ag2O + 4NH4OH à 2[Ag(NH3)2]OH + Н2O
Окислительное действие оксида серебра объясняется тем, что это вещество является оксидом благородного металла, поэтому оксид неустойчив и при наличии восстановителя, т.е. вещества, легко окисляющегося, он легко отдает кислород, вследствие чего происходит выделение (восстановление) металлического серебра. Уравнение реакции можно дать в обычном виде:

а можно представить полное уравнение реакции:

Серебряное зеркано образуется в том случае, если восстанавливающееся серебро осаждается на гладких стенках сосуда из не слишком концентрированных растворов. Малейшие загрязнения мешают восстанавливающемуся серебру «уцепиться» за стекло и заставляют его выделяться в виде рыхлого осадка. Значительно меньшее влияние на успех опыта оказывает характер нагревания. Если сосуд недостаточно чист, то даже самое осторожное нагревание не дает зеркала, и наоборот, если сосуд подготовлен тщательно, то даже нагревание смеси на открытом огне может дать желаемый результат.
Первый опыт получения серебряного зеркала следует провести в колбочке, а не в пробирке.
Колбу емкостью 50—100 мл до урока очищают от механических загрязнений, промывают ершиком с мыльной водой или нагревают в колбе раствор щелочи, затем споласкивают водой, промывают хромовой смесью и наконец начисто промывают дистиллированной водой.
В колбу наливают на четверть объема 2-процентный раствор нитрата серебра, затем добавляют постепенно раствор аммиака
(25-процентный аммиак следует разбавить в 8-10 раз) до тех пор, пока образующийся вначале осадок не растворится в его избытке. К образующемуся раствору добавляют осторожно по стенке 0,5-1 мл формалина и помещают колбу в стакан с горячей (лучше кипящей) водой. Вскоре в колбе образуется красивое серебряное зеркало.
Колбу можно нагревать без водяной бани, непосредственно на маленьком пламени, обнося пламя вокруг колбы и не встряхивая ее.
При демонстрации опыта вместо серебряного зеркала иногда образуется черный осадок. Учитель в таком случае обычно совершенно бракует опыт. Между тем при таком результате следует разъяснить учащимся, что здесь также произошло восстановление серебра только в виде рыхлого черного осадка.
Окисление формальдегида гидроксидом меди (II). В пробирку наливают 2 мл 5-процентного раствора формальдегида, 2 мл 10-процентного раствора гидроксида натрия и при встряхивании добавляют по каплям 2-процентный раствор сульфата меди (11) до появления неисчезающей взвеси. Содержимое пробирки нагревают до начала кипения и наблюдают изменение окраски реакционной смеси а именно: голубая окраска меняется на желтую (осадок), а затем на красную (осадок). Эта реакция, как и реакция серебряного зеркала, является качественной реакцией на альдегиды. Суммарное уравнение этой реакции следующее:

Однако с учащимися целесообразно рассматривать этот процесс поэтапно:
CuSO4 + 2NaOH = Си(ОН)2 + Na2SO4
Голубой


2CuOH à Cu2O + H2O
красный
Обращают внимание учащихся на то, что реакция протекает в
щелочной среде, поэтому образуется не муравьиная кислота, а соль как продукт нейтрализации. Изменяющаяся цветовая гамма продуктов является результатом превращений соединений меди, связанных с изменением степени ее окисления.
Дезинфицирующее действие формальдегида. Дезинфицирующее действие формальдегида объясняется его свойством свертывать белок.
К нескольким миллилитрам формалина в пробирке добавляют 1 мл куриного белка. Белок свертывается.
Полимеризация и деполимеризация альдегида. Формальдегид, как это впервые показал А.М.Бутлеров, легко уплотняется.
В продаже существует твердый полимер формальдегида — параформальдегид (СН2О)n или параформ.
а) Параформ может быть легко деполимеризован.
В сухую пробирку помещают несколько крупинок параформа и нагревают. Вещество разлагается, образуя газообразный формальдегид, который частично улетает (запах!), а частично на холодных стенках пробирки снова образуется полимер. Опыт объясняет применение параформа для дезинфекции помещений.
б) Полимеризацию формальдегида можно наблюдать при выпаривании его раствора.
Выпаривают осторожно на водяной бане в фарфоровой чашке 4—5 мл формалина. Образуется твердый остаток. Остаток нагревают на голом огне. Происходит деполимеризация и улетучивание продукта (вытяжной шкаф). Убедившись в этом, прекращают нагревание.
Взаимодействие формальдегида с аммиаком. Нагревая формальдегид с аммиаком, А.М.Бутлеров получил уротропин, широко известное антисептическое средство.
В фарфоровой чашке на водяной бане выпаривают смесь равных объемов формалина и концентрированного раствора аммиака. По мере улетучивания жидкости остаются бесцветные кристаллы уротропина (гексаметилентетрамина (CH2)6N4)N.

Знакомство учащихся со структурной формулой уротропина может быть лишь довольно поверхностным, так как класс аминов
еще не изучался. Однако структурная формула может быть ими осмыслена на основе знания валентности элементов.
С синтезированным или готовым уротропином можно выполнить следующие опыты. Нагревают уротропин в фарфоровой чашке, он улетучивается не плавясь. Раствор уротропина даст щелочную реакцию. При действии раствора щелочи уротропин разлагается, выделяющийся аммиак можно обнаружить обычными способами. При действии раствора серной кислоты на раствор уротропина (нагревание) также происходит разложение его, выделяющийся формальдегид может быть обнаружен по запаху.
Получение фенолформальдегидных смол. Основная масса получаемого в промышленности формальдегида идет на синтез фенолформальдегидных и других смол, необходимых для производства пластических масс. В основе получения фенолформальдегидных смол лежит реакция поликонденсации.
Наиболее доступен в школьных условиях синтез фенолформальдегидной смолы. Учащиеся к этому времени знакомы уже с обоими исходными веществами для получения смолы — фенолом и формальдегидом; опыт сравнительно несложен и идет безотказно; химизм процесса не представляет особой трудности для учащихся, если изобразить его следующим образом:

В зависимости от количественного соотношения фенола и формальдегида, а также от применяемого катализатора (кислотный или щелочной) может получаться новолачная или резольная смола. Первая из них термопластична и имеет линейную структуру, приведенную выше. Вторая — термореактивна, так как в ее линейных молекулах содержатся свободные спиртовые группы — СН2ОН, способные реагировать с подвижными водородными атомами других молекул, в результате чего образуется трехмерная структура.
В процессе классного изучения нет необходимости отдельно демонстрировать опыты получения новолачной и резольной смолы. Достаточно показать на одном опыте сам факт образования
высокомолекулярного соединения. В процессе внеклассных занятий можно получить смолы разного типа и даже формовать изделия из них. Опыты необходимо проводить под тягой вследствие летучести формальдегида.
а) Нагревают в пробирке на пламени спиртовки смесь 2,5 г кристаллического фенола и 5 мл формалина (40-процентного). Даже при кипении жидкости в ней не наблюдается химической реакции. Приливают к смеси 7-8 капель соляной кислоты (1: 1). Вскоре происходит бурная реакция, и жидкость становится мутной. Охлаждают пробирку и дают смеси отстояться: внизу образуется смола, сверху — вода. Сливают водный слой и выливают смолу на лист картона или жести. Застывшая смола имеет светло-желтую окраску. Опыт убедительно показывает роль соляной кислоты как катализатора реакции.
б) Не ставя целью показать роль катализатора, опыт можно провести проще. Нагревают в пробирке смесь указанных выше количеств фенола, формальдегида и кислоты, пока не начнется бурная реакция. После того как образуется муть, дают смеси расслоиться и далее поступают как в предыдущем случае.
Не нашли, что искали? Воспользуйтесь поиском: