
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электропроводность растворов электролитов
Проводники I рода – металлы и их расплавы, в которых электричество переносится электронами.
Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости.
Электрический ток есть упорядоченное перемещение заряженных частиц.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:

Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток.
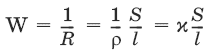
Удельная электропроводность χ(к) – электропроводность проводника I рода длиной 1 м с площадью поперечного сечения 1 м2 или электропроводность 1 м3 (1 см3) раствора электролита (проводника II рода) при расстоянии между электродами 1 м (1 см) и площади электродов 1 м2 (1 см2).

Молярная электропроводность раствора) λ – электропроводность раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга.

Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т. е. с увеличением разведения раствора V = 1/C), достигая некоторого предельного значения λ 0 (λ∞), называемого молярной электропроводностью при бесконечном разведении.
Для бинарного электролита с однозарядными ионами при постоянной температуре и напряженности поля 1 В • м-1:
λ = α F(u + + и¯),
где F – число Фарадея; и+, и¯ – абсолютные подвижности (м2В-1с-1) катиона и аниона – скорости движения данных ионов в стандартных условиях, при разности потенциалов в 1В на 1 м длины раствора.
λ+ = Fu+; λ¯ = Fu¯,
где λ +, λ¯ – подвижности катиона и аниона, Ом • м2 • моль-1 (Ом • см2 • моль-1).
λ = α(λ+ + λ¯)
Для сильных электролитов α ≈1 и λ = λ+ + λ¯
При бесконечном разбавлении раствора (V → ∞, λ + → λ∞ +, λ¯ → λ∞ ¯, α → 1) как для сильного, так и для слабого электролитов λ∞ = λ∞ + – λ∞ ¯ – закон Кольрауша: молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей λ∞ +, λ∞ ¯ катиона и аниона данного электролита.
Ионы Н+ и OH¯ обладают аномально высокой подвижностью, что связано с особым механизмом переноса заряда этими ионами – эстафетным механизмом. Между ионами гидроксония Н3O+ и молекулами воды, а также между молекулами воды и ионами OH¯ непрерывно происходит обмен протонами по уравнениям:
Н3O+ + Н2O → Н2O + Н3O+
Н2O + OH¯ → OH¯ + Н2O
Не нашли, что искали? Воспользуйтесь поиском: